Alkan
Alkani, znani tudi kot parafini, so kemijske spojine ogljika (C) in vodika (H). Vse vezi v molekuli so enojne kovalentne vezi, ogljikovi atomi pa tvorijo verigo, ki je linearna ali razvejana, vendar je brez zank in obročev. Alkani zato spadajo med nasičene aciklične ogljikovodike in tvorijo homologno vrsto s splošno formulo CnH2n+2. Sosednji členi homologne vrste se med seboj razlikujejo za eno –CH2– skupino.
Funkcionalna skupina alkanov je alkilna skupina s splošno formulo CnH2n+1. Takšni funkcionalni skupini sta na primer metilna CH3– in etilna skupina C2H5–.
Ogljikove verige nižjih alkanov so linearne, spojine z več kot tremi ogljikovimi atomi pa lahko tvorijo tudi razvejane molekule. Pojav imenujemo skeletna izomerija:
Alkani z več kot dvema atomoma ogljika lahko tvorijo obroče s splošno formulo CnH2n in zanke – obroče, vezane na osnovno linearno ali razvejano ogljikovo verigo. Takšne alkane prištevamo k cikloalkanom.[1] Alkane lahko torej v grobem delimo na acilkične (linearne in razvejane) alkane ter cikloalkane, ki vsebujejo obroče in zanke.
Najenostavnejši alkan je metan (CH4), sicer pa število ogljikovih atomov navzgor ni omejeno. Edina omejitev je, da je spojina sestavljena samo iz ogljika in vodika in da je nasičena, se pravi da ima samo enojne vezi.
Izomerija alkanov
urediIzomerija je pojav, pri katerem ima spojina z eno molekulsko formulo več različnih strukturnih formul.
Alkani z enim, dvema ali tremi ogljikovimi atomi imajo samo eno možno razporeditev ogljikovih atomov, torej imajo samo en izomer. Alkan s štirimi ogljikovimi atomi je prvi, ki lahko ima stransko verigo – metilno skupino CH3- in zato dva izomera: butan in 2-metilpropan. Z naraščajočim številom ogljikovih atomov število izomerov naglo narašča:
- C1:1 izomer – metan
- C2:1 izomer – etan
- C3:1 izomer – propan
- C4:2 izomera - butan in 2-metilpropan
- C12:355 izomerov
- C32:27.711.253.769 izomerov
- C60:22.158.734.535.770.411.074.184 izomerov
Linearne izomere so včasih imenovali normalni in jih označevali s črko n-, razvejane izomere pa so označevali z izo-.
Razvejani alkani so lahko kiralni, se pravi da imajo dve zrcalni strukturi. 3-metilheksan in njegovi višji homologi so hiralni zaradi asimetričnega 3. ogljikovega atoma, na katerem so vezane štiri različne skupine: H-, CH3-, CH3-CH2- in CH3-CH2-CH2-. Kiralni alkani so pomembni predvsem v biokemiji, kjer se pojavljajo kot stranske verige v klorofilu in tokoferolu (vitaminu E). Hiralne alkane lahko ločimo v njihove enanciomere (stereoizomere) s kromatografijo.[2]
Poleg razvejanih izomerov lahko alkani tvorijo tudi enega ali več obročev. Takšne spojine prištevamo k cikloalkanom.
Nomenklatura
urediNomenklatura alkanov, ki jo predpisuje IUPAC, temelji na identifikaciji ogljikovih verig.
Nerazvejane verige nasičenih ogljikovodikov imajo imena grških števil s pripono –an.[3] Izjema so prvi štirje alkani (metan, etan, propan in butan) ter nonan, undekan in tridekan.
Pripona –an je del sistematičnega poimenovanja ogljikovodikov, ki ga je predlagal nemški kemik August Wilhelm von Hofmann (1818–1892): -an za nasičene ogljikovodike, -en in –in za ogljikovodike z eno dvojno oziroma trojno vezjo, -on za ketone, -ol za alkohole in –oksi za etre.
Linearni alkani
urediLinearni alkani, ki so imeli tudi razvejane izomere, so se včasih označevali s predpono n- kot normalen. Ta predpis ni več obvezujoč, še vedno pa se uporablja v primerih, ko imata linearni in razvejani izomer zelo različne lastnosti, na primer n-heksan in 2- ali 3-metilpentan.
Prvi štirje člani homologne vrste alkanov
- metan, CH4
- etan, C2H6
- propan, C3H8
- butan, C4H10
so dobili po imena po metanolu, etru, propionovi kislini in masleni kislini (iz grškega βούτυρος, butiros = maslo). Alkani s petimi ali več ogljikovimi atomi imajo imena grških števil brez zadnjega samoglasnika, katerim je dodana končnica –an, na primer pentan za C5H12, heksan za C6H14, dodekan za C12H26 itd. Izjeme so nonan, ki je izpeljan iz latinskega novem za število devet, ter undekan in tridekan, ki imata imeni, sestavljeni iz obeh jezikov.
Razvejani alkani
urediOgljikove atome je treba šteti z leve, ker bo v tem primeru metilna skupina na 2. C atomu (če bi šteli z desne, bi bila na 3.)
Pravilno ime je torej 2-metibutan.
Enostavni linearni in razvejani alkani imajo pogosto enako ime in se med seboj razlikujejo po predponah, na primer n-pentan, izo-pentan in neo-pentan.
Za poimenovanje alkanov po sistemu IUPAC veljajo naslednja pravila:[4]
- Poiščemo najdaljšo neprekinjeno verigo ogljikovih atomov v molekuli in jo imenujemo glede na število ogljikovih atomov.
- Oštevilčimo ogljikove atome. Številčiti začnemo s tiste strani, s katere ima ogljikov atom, na katerega je vezana alkilna skupina, manjšo številko.
- Če je alkilnih skupin več, začnemo številčiti s tiste strani, s katere je vsota številk ogljikovih atomov, na katerih so vezane, manjša.
- Če je v alkanu samo ena alkilna skupina, povemo njen položaj in ime, na primer 2-metilbutan ali 3-etillheksan.
- Če je na osnovno verigo vezanih več enakih alkilnih skupin, naštejemo njihove položaje, njihovo število pa označimo s predponami di-, tri-, tetra-, penta- itd, na primer 3,4-dimetil heksan ali 2,2,3,3-tetraetildekan.
- Če je na osnovno verigo vezanih več različnih alkilnih skupin, oštevilčimo in preštejemo vsako skupino posebej. Zapišemo jih po abecedi, ne glede na njihov položaj na ogljikovi verigi, na primer 5-etil-6,6-dimetil-4-propilundekan.
Cikloalkani
urediCikloalkani so nasičeni ogljikovodiki z enim ali več obroči. Enostavni cikloalkani imajo, da se razlikujejo od acikličnih alkanov, pred svojim imenom predpono ciklo-, na primer cikloheksan (C6H12) ali ciklooktan (C8H16).
Substituirani (razvejani) cikloalkani se poimenujejo na podoben način kot razvejani alkani. Številčenje ogljikovih atomov se podreja Cahn-Ingold-Prelogovim pravilom,[5] ki določajo prioriteto substituent in funkcionalnih skupin.
Trivialna (nesistematična) imena
urediTrivialno ime alkanov je parafini, njihova homologna vrsta pa parafinska vrsta. Trivialno ime cikloalkanov je nafteni. Trivialna imena posameznih alkanov so večinoma zgodovinska dediščina. Nastala so iz imen, ki so udomačila v industriji.
Imeni »parafini« in »nafteni« sta gotovo nastali v naftni industriji. Nekaj trivialnih imen se je obdržalo tudi v sistemu IUPAC, na primer
- izobutan za 2-metilpropan
- izopentan za 2-metilbutan in
- neopentan za 2,2-dimetilpropan.
| Trivialno ime | n-pentan | izopentane | neopentan |
|---|---|---|---|
| IUPAC | pentan | 2-metilbutan | 2,2-dimetilpropane |
| Skeletna formula |
Nahajališča
urediNahajališča v vesolju
urediAlkani tvorijo velik del atmosfere zunanjih plinastih planetov našega Osončja. V Jupitrovi atmosferi je 0,1 % metana in 0,0002 % etana, v Saturnovi 0,2 % metana in 0.0005 % etana, v Uranovi 1,99 % metana in 0,00025 % etana ter v Neptunovi 1,5 % metana in 1,5 ppm etana. Meritve vesoljske sonde Huygens so pokazale, da je v atmosferi Saturnovega satelita Titana 1,6 % metana, ki utekočinjen občasno »dežuje« na njegovo površino.[6] Na radarskih slikah sonde Cassini so opazili tudi vulkane, ki bruhajo metan, v bližini severnega pola pa jezera tekočega metana in etana. Metan in etan so odkrili tudi v meteoritih in ogljikovih hondritih ter v repu kometa Hyakutake. Kemijska analiza je pokazala, da sta količini metana in etana v repu približno enaki. To pomeni, da je led nasatal verjetno v medzvezdnem prostoru daleč od Sonca, ker bi v bližini Sonca že prej izparel.[7]
Nahajališča na Zemlji
urediV Zemljini atmosferi so samo sledovi metana (okrog 1 ppm), ki je večinoma produkt arhej. Najpomembnejša zemeljska vira komercialnih alkanov sta zemeljski plin in nafta.[8] Zemeljski plin je sestavljen v glavnem iz metana in etana z manjšimi primesmi propana in butana. Nafta je zmes tekočih alkanov in drugih ogljikovodikov. Ogljikovodiki so nastali iz odmrlih morskih organizmov in planktona (zooplanktona in fitoplanktona), ki so potonili na dno oceanov ter se v anaerobnih pogojih v milijonih let pod visokim pritiskom in visoko temperaturo pretvorili v nafto. Naravni plin nastaja tudi iz enostavnih sladkorjev z naslednjo reakcijo:
C6H12O6 → 3CH4 + 3CO2
Ogljikovodiki so se zbrali v poroznih kamninah med skladi neprepustnih kamnin na tako imenovanih naftnih poljih. Metan v naravi še vedno nastaja v velikih količinah, nahajališča alkanov z več kot devetimi ogljikovimi atomi pa so v naravi redka in količinsko omejena. Svetovne zaloge nafte so omejene in v realnem času neobnovljive.
Trdni alkani so bitumni oziroma asfalti, ki so nastali z izparevanjem hlapnih komponent iz depozitov ogljikovodikov. Eno največjih nahajališč trdnih alkanov je asfaltno jezero v bližini La Bree v Trinidadu in Tobagu. Jezero ima površino 46 ha in je do 106 m globoko.[9]
Alkani so slabo topni v vodi, zato je njihova količina v oceanih zanemarljiva. Pri visokih pritiskih in nizkih temperaturah, kakršne vladajo dnu oceanov, lahko metan sokristalizira z vodo in tvori trdni metan hidrat.[10] Komercialno izkoriščanje metan hidrata trenutno še ni zanimivo, ker so njegova nahajališča preveč razpršena, čeprav količina energije na do sedaj znanih nahajališčih presega skupno količino energije naravnega plina in nafte[11] Obsežne raziskave o izkoriščanju metan hidrata potekajo na Japonskem in vse kaže, da se bo njegovo izkoriščanje začelo že leta 2016.[12]
Biološka nahajališča
urediAlkani v biološkem smislu ne spadajo med esencialne snovi. Cikloalkani s 14 do 18 ogljikovimi atomi se pojavljajo v mošusu, snovi značilnega predirnega vonja, ki jo izločajo moškatni jeleni, pižmovke in nekatere druge živali.
Bakterije in arheje
Nekatere vrste bakterij lahko presnavljajo alkane. Raje imajo spojine s sodim številom ogljikovih atomov kot z lihim, ker so slednje težje razgradljive. Nekatere vrste arhej, na primer metanogene, proizvajajo velike količine metana s presnavljanjem ogljikovega dioksida in drugih kisikovih organskih spojin.[13]
CO2 + 4H2 → CH4 + 2H2O
Metanogene proizvajajo tudi »močvirski plin« (metan). Letna količina v atmosfero sproščenega metana je okrog 2 milijardi ton. Metanogene arheje so torej zadnji člen ogljikovega cikla v ekosistemu: v atmosfero sproščajo ogljik, ki so ga iz atmosfere vezale rastline s fotosintezo.
Metan je presnovni produkt goveda in drugih rastlinojedih živali, tudi termitov in človeka. Dnevna količina sproščenega metana je okrog 150 l na govedo na dan.
Glive in rastline
Alkani igrajo v biologiji evkariotov (gliv, rastlin in živali) manj pomembno vlogo. Nekatere specializirane kvasovke, na primer Candida tropicale in kvasovke iz rodu Pichia in Rhodotorula , uporabljajo alkane kot vir hrane in/ali energije. Gliva Amorphotheca resinae ima najraje alkene z dolgimi verigami, ki so sestavnina letalskih goriv, zato v tropih povzroča letalskim prevoznikom resne težave.
V rastlinah najdemo trdne alkane z dolgimi verigami. Alkani tvorijo na površini rastline zaščitno plast voskov, kutikulo, ki ščiti rastlino pred izhlapevanjem vode in izluževanjem mineralov zaradi padavin. Rastlino ščiti tudi pred bakterijami, glivami in škodljivimi žuželkami, ker se žuželke po gladkih listih teže gibljejo in ležejo jajčeca. Voske najdemo tudi na površini sadja, na primer jabolk. Voski imajo v svojih verigah od dvajset do trideset ogljikovih atomov in nastajajo iz višjih mastnih kislin. Natančna sestava kutikule je odvisna od rastline in se med letom spreminja, odvisno od jakosti sončne svetlobe, temperature in vlažnosti.
Živali
Alkane najdemo tudi v živalskih proizvodih, vendar so manj pomembni kot nenasičeni ogljikovodiki. V olju iz jeter morskih psov je približno 14 % pristana C19H40 (2,6,10,14-tetrametilpentadekan).[14] Alkani so pomembna sestavina feromonov, kemijskih spojin, s katerimi komunicirajo žuželke. Nekatere vrste zalubnikov, na primer Xylotrechus colonus, uporabljajo predvsem pentakozan (C25H52), 3-metilpentaikozan (C26H54) in 9-metilpentaikozan (C26H54), ki jih izmenjavajo s telesnim stikom. Feromoni muhe cece (Glossina morsitans morsitans) vsebujejo štiri alkane: 2-metilheptadekan (C18H38), 17,21-dimetilheptatriakontan (C39H80), 15,19-dimetilheptatriakontan (C39H80) in 15,19,23-trimetilheptatriakontan (C40H82), ki deluje na velike razdalje. Čebele med plesom izločajo dva alkana: trikozan in pentakozan.[15]
Simbioza
Simbioza, v kateri igrajo pomembno vlogo rastlinski in živalski alkani, je simbioza med kukavičevko Ophrys sphegodes in njeno opraševalko, peščinsko čebelo vrste Adrena nigroaena. Matice omenjene čebele uporabljajo za privabljanje trotov feromon, ki je zmes trikosana (C23H48), pentakosana (C25H52) in heptakosana (C27H56) v razmerju 3:3:1. Orhideja izkorišča to paritveno komunikacijo za opraševanje svojih cvetov. Njeni cvetovi izločajo omenjene tri alkane v ravno pravem razmerju, da privabljajo čebelje samce, del njenega cveta pa se je celo preoblikoval, tako da je podoben čebelji matici.
Proizvodnja
urediRafiniranje nafte
urediNajpomembnejša vira alkanov sta zemeljski plin in nafta.[8] Zmes alkanov ločimo na posamezne komponente s frakcionirano destilacijo v rafinerijah nafte.
Fischer-Tropschova sinteza
urediFischer-Tropschova sinteza je postopek za pridobivanje tekočih ogljikovodikov, tudi alkanov, iz ogljikovega monoksida in vodika:
(2n+1)H2 + nCO → CnH(2n+2) + nH2O
Metoda se je uporabljala predvsem za proizvodnjo sintetičnega bencina.
Laboratorijska sinteza
urediLaboratorijske sinteza alkanov običajno niso potrebne, ker so na razpolago ceneni komercialni proizvodi, po drugi strani pa pri sintezah običajno dobimo več izomerov, ki jih je z enostavnimi metodami, na primer z destilacijo, težko ločiti. Štiri najnižje alkane lahko pripravimo v čisti obliki z destilacijo, višjih alkanov pa na ta način ne moremo popolnoma ločiti. Za njihovo pripravo je na razpolago več možnosti.
- Najenostavnejše je hidrogeniranje nenasičenih ogljikovodikov, na primer alkenov, dienov in alkinov. Reakcija poteka v prisotnosti katalizatorjev iz platinske skupine (platina, paladij) ali železove skupine (železo, nikelj, kobalt):
- CH2=CH2 + H2 → CH3–CH3
- Z redukcijo primarnih alkoholov z jodovodikom:
- R–CH2OH + 2HI → I2 + H2O + R–CH3
- Na enak način lahko reduciramo tudi karboksilne kisline:
- R–COOH + 6HI → 3I2 + 2H2O + R–CH3
- Z redukcijo aldehidov ali ketonov z vodikom, ki ga pripravimo sproti v reakcijski zmesi iz cinkovega prahu in klorovodikove kisline:
- R–CH=O + 2Zn + 4HCl → 2ZnCl2 + H2O + R–CH3 (aldehidi)
- R–CO–R″ + 2Zn + 4HCl → 2ZnCl2 + H2O + R′–CH2–R″ (ketoni)
- Iz bazičnih soli karboksilnih kislin, pri čemer se ogljikova veriga skrajša za en ogljikov atom:
- R–COONa + NaOH → RH + Na2CO3
- Iz halogenalkanov, predvsem jodoalkanov, z reakcijo s cinkom, pri čemer se število ogljikovih atomov v alkanu podvoji:
- 2R–I + Zn → ZnI2 + R–R
Na razpolago je še več drugih sintez, ki so bolj zapletene ali pa se uporabljajo za posebne namene.
Uporaba
urediUporabnost alkanov je zelo natančno pogojena s številom ogljikovih atomov. Prvi štirje alkani se uporabljajo predvsem za goriva v gospodinjstvu in industriji ter za proizvodnjo električne energije v plinskih elektrarnah. Metan in etan sta glavni komponenti zemeljskega plina, ki se od nahajališč do porabnikov prevaža v plinastem stanju pod visokim pritiskom ali v tekočem stanju (UZP) v ohlajenih tlačnih posodah.
Propan in butan se utekočinita pri nižjih tlakih in sobni temperaturi in sta znana kot utekočinjeni naftni plin (UNP) ali gospodinjski plin. Propan se uporablja v glavnem za ogrevanje, butan tudi za polnjenje plinskih vžigalnikov za enkratno uporabo, oba pa kot potisni plin v pršilih.
Alkani od pentana do oktana so lahko hlapne tekočine – bencini - in se uporabljajo kot pogonska goriva v motorjih z notranjim zgorevanjem. Razvejani izomeri so bolj zaželeni kot linearni, ker so bolj odporni na samovžig pri povečanem tlaku, ki povzroča klenkanje motorja. Nagnjenje k samovžigu se meri z oktanskim številom goriva. Referenčna alkana za določanje oktanskega števila sta 2,2,4-trimetilpentan (izooktan), ki ima po dogovoru oktansko število 100 in heptan, ki ima oktansko število 0. Primer: bencin z oktanskim številom 95 se obnaša enako kot zmes 95 % izooktana in 5 % heptana. Bencini so tudi pomembna industrijska nepolarna topila.
Alkani od nonana (C9H18) do heksadekana (C16H34) so tekočine z visokimi vrelišči ter večjo viskoznostjo kot bencini in niso primerni za pogon bencinskih motorjev. Uporabljajo se v glavnem kot dizelska in letalska goriva (kerozin). Kakovost dizelskih goriv se meri s cetanskim številom (cetan je staro ime za heksadekan). Zaradi višjih tališč se njihova viskoznost pri nizkih temperaturah tako poveča, da pozimi v polarnih področjih povzroča težave.
Alkani od heksadekana navzgor so pomembna sestavina kurilnega olja in mineralnih olj, ki se uporabljajo kot maziva. Maziva imajo tudi antikorozivno delovanje, ker so hidrofobna, tako da voda ne more priti v neposreden stik s kovinskimi površinami. Trdni alkani so parafinski voski, ki jih ne smemo zamenjati s pravimi voski, ki so pretežno estri višjih mastnih kislin. Parafinski voski se uporabljajo za izdelavo sveč.
Alkani s 35 ali več ogljikovimi atomi so sestavine bitumnov in se uporabljajo za asfaltiranje cest. Alkani z velikim številom ogljikovih atomov imajo majhno tržno vrednost, zato se s krekiranjem pretvarjajo v bolj uporabne alkane z manjšim številom ogljikovih atomov.
Alkanom so podobni nekateri sintetični polimeri s sto do tisoč ogljikovimi atomi, na primer polieten (polietilen) in polipropen (polipropilen). Takšni polimeri so vsestransko uporabni, zato njihova letna proizvodnja znaša več milijonov ton.
Fizikalne lastnosti
urediVrelišče
urediV alkanih delujejo van der Waalsove sile - močnejše so, višja so njihova vrelišča. Na jakost van der Waalsovih sil najbolj vpliva
- število elektronov v ovojnici molekule; njihovo število raste s številom ogljikovih atomov.
- površina molekule, ki prav tako raste s številom ogljikovih atomov.
Pri standardnih pogojih so zato alkani od CH4 do C4H10 plinasti, od C5H12 do C17H36 tekoči, od C18H38 pa trdni. Ker na temperaturo vrelišča alkanov vpliva predvsem njihova molska masa, ni nič čudnega, da krivulja njihovih vrelišč zelo enakomerno narašča: vsak dodani ogljikov atom dvigne temperaturo vrelišča za 20-30 °C.
Linearni alkani imajo večjo kontaktno površino kot razvejani alkani. Van der Waalsove sile med sosednjimi molekulami so zato večje in temu primerno višja so tudi njihova vrelišča. Primer: izobutan (2-metilpropan) in n-butan imata vrelišči pri -12 oziroma 0 °C. 2,2-dimetilbutan in 2,3-dimetilbutan imata vrelišči 50 oziroma 58 °C. Razlog za višje vrelišče drugega izomera je ta, da se lahko njegovi dve molekuli zaradi svoje oblike usedeta ena v drugo, kar ima za posledico večje van der Waalsove sile.
Cikloalkani imajo višja vrelišča kot aciklični alkani z enakim številom ogljikovih atomov, ker so njihove molekule ploske, kar poveča njihovo stično površino.
Tališče
urediZaradi van der Waalsovih sil kažejo tališča alkanov enake trende kot njihova vrelišča. Iz grafa tališč (modra krivulja) je razvidno, da imajo alkani z lihim številom ogljikovih atomov nekoliko nižja tališča od pričakovanih. Alkani z lihim številom ogljikovih atomov imajo namreč v trdnem stanju bolj organizirano in zato bolj kompaktno zgradbo kot alkani s sodim številom ogljikovih atomov, zato je za porušenje zgradbe potrebna več energije.[16]
Tališča razvejanih alkanov so lahko višja ali nižja od tališč ustreznih alkanov z ravnimi verigami, odvisno od gostote njihove zgradbe v trdnem stanju. To je še posebno opazno pri izoalkanih (2-metil izomerih), ki imajo višja tališča od ustreznih linearnih izomerov.
| Ime | Formula | Tališče [°C] | Vrelišče [°C] | Gostota pri 20° [g cm−3]) |
| Metan | CH4 | -183 | -162 | plin, 0,667 kg/m³ |
| Etan | C2H6 | -172 | -89 | plin, 1,212 kg/m³ |
| Propan | C3H8 | -188 | -42 | plin, 1,830 kg/m³ |
| Butan | C4H10 | -135 | -0,5 | plin, 2,703 kg/m³ |
| Pentan | C5H12 | -130 | 36 | tekoč, 0,626 |
| Heksan | C6H14 | -95 | 69 | tekoč, 0,659 |
| Heptan | C7H16 | -91 | 98 | tekoč, 0,684 |
| Oktan | C8H18 | -57 | 126 | tekoč, 0,703 |
| Nonan | C9H20 | -54 | 151 | tekoč, 0,718 |
| Dekan | C10H22 | -30 | 174 | tekoč, 0,730 |
| Undekan | C11H24 | -26 | 196 | tekoč, 0,740 |
| Dodekan | C12H26 | -10 | 216 | tekoč, 0,749 |
| Triakontan | C30H62 | 37 | 343 | trden |
Prevodnost, topnost, gostota
urediAlkani ne prevajajo električnega toka. V električnem polju se ne polarizirajo, ne tvorijo vodikovih vezi in se zato niti ne mešajo niti raztapljajo v polarnih topilih, na primer v vodi. Alkani so torej hidrofobni.
Topnost alkanov v nepolarnih topilih je relativno dobra. To lastnost imenujemo liofilnost. Alkani se med seboj mešajo v vseh razmerjih. Gostota alkanov z naraščajočim številom ogljikovih atomov raste, vendar nikoli ne doseže gostote vode, kar pomeni, da vsi alkani plavajo na vodi.
Geometrija molekul
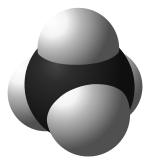
urediFizikalne in kemijske lastnosti alkanov so odvisne od strukture njihove molekule. Struktura alkanov je posledica elektronske konfiguracije ogljika, ki ima štiri valenčne elektrone. Valenčni elektroni ogljika v alkanih so vedno sp3 hibridizirani, se pravi, da so razporejeni na štirih enakovrednih orbitalah, ki so nastale s hibridizacijo ene 2s in treh 2p podorbital. Orbitale imajo enake energije in so v prostoru razporejene v obliki tetraedra. Koti med njimi merijo cos−1(-⅓)≈109,47°.
Dolžina vezi in koti med njimi
urediV molekulah alkanov so samo enojne vezi C-H in C-C. Vez C-H nastane s čelnim prekrivanjem ene sp3 orbitale ogljika z 1s orbitalo vodika. Vezi C-C nastanejo s čelnim prekrivanjem po ene sp3 orbitale dveh sosednjih ogljikovih atomov. Dolžina vezi C-H je 1,09 Å, vezi C-C pa 1,54 Å.
Prostorska razporeditev vezi je podobna razporeditvi štirih sp3 orbital, se pravi tetraedrična, s koti približno 109°.
Konformacije
urediStukturna formula alkana in koti med vezmi pogosto niso dovolj za popoln opis geometrije molekule. Treba je poznati tudi prostostno stopnjo vsake vezi C-C, se pravi kot sukanja med atomi ali skupinami, ki so vezane na eni in drugi strani vezi. Prostorsko razporeditev, ki je določena s sukanjem oziroma zvijanjem molekule, imenujemo konformacija.
Najenostavnejši model za študij konformacij alkanov je etan, ker ima samo dva ogljikova atoma in eno enojno vez C-C. Če pogledamo molekulo vzdolž osi C-C (Newmanova projekcija), vidimo, da merijo koti med vodikovimi atomi na prednjem in zadnjem ogljikovem atomu 120° (tloris tetraedra). Kot med izbranim vodikovim atomom na prvem ogljikovem atomu in izbranim vodikovim atomom na zadnjem ogljikovem atomu se lahko spreminja od 0 do 360°, ker se lahko zadnja metilna skupina zaradi enojne vezi neovirano vrti okrog vezi C-C. Kljub tej navidezni svobodi sta možni samo dve konformaciji: poravnana (ekliptična) in zamaknjena.
Obe konformaciji se imenujeta tudi rotamera in imata različni notranji energiji. Zamaknjena konformacija ima za 12,6 kJ/ mol nižjo energijo od poravnane in je zato bolj stabilna. Razlika v energiji med obema konformacijama je majhna v primerjavi s toplotno energijo etanove molekule, zato se metilna skupina stalno vrti okrog vezi C-C. Čas vrtenja je reda velikosti 10−11 sekund.
Konformacije višjih alkanov so bolj zapletene, vendar se obnašajo po enakih principih kot etan. Realne strukture se seveda razlikujejo od idealnih struktur in modelov, ker so razlike v energijah konformacij neznatne v primerjavi s celotno toplotno energijo molekule. Struktura alkanov vsekakor ni fiksna, kakršno prikazujejo modeli.
Spektroskopske lastnosti
urediAlkani imajo v svoji zgradbi samo vezi C-C in C-H in nimajo nobenih funkcionalnih skupin. Temu primerne so njihove spektroskopske značilnosti.
Infrardeča spektroskopija
urediEnostavna dvoatomna molekula ima eno samo vez, ki se lahko razteza in krči. Bolj kompleksne molekule imajo več vezi, katerih nihanje je lahko konjugirano. Takšno nihanje povzroči absorpcijo nekaterih frekvenc infrardeče svetlobe, ki so značilne za posamezne funkcionalnimi skupine. Skupina -CH2-, ki je značilna za alkane, lahko niha na šest možnih načinov: simetrično in asimetrično raztezanje, striženje, guganje, kimanje in zvijanje.
| Simetrično raztezanje |
Asimetrično raztezanje |
Striženje | Guganje | Kimanje | Zvijanje |
|---|---|---|---|---|---|
Raztezanje vezi C-H absorbira svetlobo med 2850 in 2960 cm−1, nihanje vezi C-C pa svetlobo med 800 in 1300 cm−1. Upogibanje vezi C-H je odvisno od funkcionalne skupine: metilna skupina absorbira svetlobo med 1450 in 1375 cm−1, metilenska skupina pa med 1465 in 1450 cm−1. Ogljikova veriga z več kot štirimi C atomi kaže šibko absorpcijo svetlobe okrog 725 cm-1.
Jedrska magnetna resonančna spektroskopija
urediResonanca protona (vodika) alkanov je običajno pri δH=0,5-1,5. Resonance C-13 so odvisne od števila vodikovih atomov, ki so vezani na ogljikov atom: δC=8-30 (primarni C atom, -CH3), 15-55 (sekundarni C atom, -CH2-), 20-60 (terciarni C atom). Resonanca C-13 kvarternih ogljikovih atomov je zaradi pomanjkanja Overhauserjevega efekta in dolgega relaksacijskega časa značilno šibka. Če so vzorci slabi ali če poskus ne traja dovolj dolgo, lahko povsem izostane.
Masna spektroskopija
urediAlkani imajo visoko ionizacijsko energijo, molekularni ion pa je šibak. Vzorec fragmentov je težko interpretirati, ogljikova veriga razvejanih alkanov pa se zaradi relativne stabilnosti nastalih prostih radikalov očitno najraje cepi pri terciarnem ali kvarternem ogljikovem atomu. Fragment, ki nastane zaradi odcepitve posamezne metilne skupine (M-15), pogosto manjka, med drugimi fragmenti pa so intervali štirinajstih masnih enot, kar odgovarja sekvenčnemu odcepljanju –CH2- skupin.
Kemične lastnosti
urediAlkani so zaradi relativno stabilnih vezi C-C slabo reaktivni. Za razliko od drugih kemičnih spojin nimajo funkcionalnih skupin.
Zelo slabo reagirajo samo z ionskimi ali polarnimi spojinami. Njihova kislinska disociacijska konstanta (pKa) je višja od 60, se pravi, da so praktično inertni do kislin in baz. Od tod tudi njihovo ime parafini, ki v dobesednem prevodu pomeni »brez afinitete«. Najboljši dokaz za njihovo nereaktivnost je nafta, ki je ostala kemično nespremenjena več milijonov let.
Redoks reakcije alkanov, posebno s kisikom in halogeni, so možne, ker je ogljik, na primer v metanu, v najnižjem možnem oksidacijskem stanju: -4. Reakcija s kisikom je popolno zgorevanje brez dima, reakcije s halogeni pa so substitucije. Alkani z nekaterimi prehodnimi elementi tvorijo kovinske komplekse, vendar je treba pred tem aktivirati vez ogljik-vodik.
Prosti radikali, se pravi molekule z neparnimi elektroni, igrajo pomembno vlogo v večini reakcij alkanov, na primer pri krekiranju in reformingu. Pri krekiranju se alkani z dolgimi verigami cepijo na alkane s krajšimi verigami, pri reformingu pa se alkani z ravnimi verigami pretvarjajo v razvejane izomere, cikloalkane in aromatske ogljikovodike.
V zelo razvejanih alkanih se kot med vezmi lahko zelo razlikuje od optimalnega kota 109º, da bi zagotovil dovolj prostora za različne alkilne skupine. Takšno odstopanje povzroči notranje napetosti v molekuli, ki jih imenujemo sterične ovire. Sterične ovire lahko bistveno povečajo reaktivnost alkanov.
Reakcije s kisikom
urediVsi alkani s kisikom popolnoma zgorijo v ogljikov dioksid in vodo:
CnH2n+2 + (3n + 12) O2 → (n + 1) H2O + n CO2
Z naraščajočim številom ogljikovih atomov se dviguje tudi temperatura vnetišča, zato se alkani z velikim številom ogljikovih atomov zelo težko vnamejo. Če je količina kisika premajhna, nastajata ogljikov monoksid in/ali saje (ogljik):
- CnH2n+2 + (n + 12) O2 → (n + 1) H2O + n CO
- CnH2n+2 + (12n + 12) O2 → (n + 1) H2O + n C
Standardna sežigna entalpija alkanov ΔHºsež se za vsako dodano CH2 skupino poveča za približno 650 kJ/mol. Razvejane spojine imajo nižje ΔHºsež kot linearne z enakim številom ogljikovih atomov in so zato nekoliko bolj stabilne.
Reakcije s halogeni
urediV reakcijah med alkani in halogeni pride do radikalske substitucije vodika s halogenom. Halogeni lahko teoretično postopoma zamenjajo vse vodikove atome v molekuli, običajno pa nastane zmes halogeniranih produktov. Reakcija je zelo eksotermna ali celo eksplozivna.
Halogeniranje alkanov je zelo pomembenno za industrijsko pridobivanje halogeniranih ogljikovodikov. Reakcija poteka v treh stopnjah:
- Iniciacija: vezi, na primer Cl-Cl, se razcepijo (homoliza), tako nastanejo radikali Cl•. Za iniciacijo je potrebna toplotna ali svetlobna energija.
- Propagacija: radikali halogena odcepijo iz alkana odcepijo vodikove atome, tako da nastanejo alkilni radikali.
- Terminacija: iz alkilnih in halogenih radikalov nastanejo halogenirani alkani.
Poskusi so pokazali, da pri halogeniranju nastane zmes vseh možnih izomerov, to pa ne pomeni, da je zmes produktov enaka statistični zmesi[17]. Zaradi večje stabilnosti sekundarnih in terciarnih prostih radikalov se halogeni raje vežejo na sekundarne in terciarne ogljikove atome. Značilen primer je monobromiranje propana:[8]
Krekiranje
urediKrekiranje je proces, v katerem se večje molekule cepijo v manjše molekule. Alkani se cepijo pri povišani temperaturi ali s pomočjo katalizatorja. Termično krekiranje poteka po homolitskem mehanizmu s tvorbo prostih radikalov. Katalitsko krekiranje poteka v prisotnosti kislih katalizatorjev (sintetični amorfni alumosilikati ali zeoliti), ki pospešujejo heterolitsko (asimetrično) cepljenje vezi C-C. S cepljenjem nastanejo ioni z nasprotnimi naboji, običajno karbokationi in zelo nestabilni hidridni anioni (H-). Prosti radikali in karbokationi so zelo nestabilni, zato pride do prerazporeditve ogljikove verige, striženja vezi C-C na položaju beta (dva C atoma od C atoma z nabojem), ter intra- in intermolekularnega prenosa hidridnega iona. V obeh procesih, termičnem in katalitskem, se reaktivni vmesni produkti (radikali, ioni) stalno obnavljajo, tako da se proces nadaljue po mehanizmu samopropagacije. Reakcije se končajo z rekombiniranjem radikalov oziroma ionov.
Izomerizacija in reforming
urediIzomerizacija je proces, v katerem se linearni alkani pretvorijo v razvejane, reforming pa je proces, v katerem se linearni alkani pretvorijo v cikloalkane ali aromatske ogljikovodike. Pri reformingu je stranski produkt vodik. Oba procesa potekata pri povišanih temperaturah in v prisotnosti platine kot katalizatorja in povečata oktansko število alkanov.
Druge reakcije
urediAlkani v prisotnosti niklja kot katalizatorja reagirajo z vodno paro, pri čemer se sprošča vodik. Alkani se lahko pod posebnimi pogoji tudi klorosulfonirajo in nitrirajo. S fermentacijo alkanov nastajajo karboksilne kisline. Žveplov dioksid, klor in svetloba pretvorijo ogljikovodike v sulfonil kloride (Reedova reakcija).
Nevarnosti
urediMetan je v 1-8 % zmesi z zrakom eksploziven in spada med toplogredne pline. Lahki tekoči alkani (bencini) so lahko vnetljive tekočine, ki tvorijo z zrakom eksplozivne zmesi. Z naraščajočim številom ogljikovih atomov se nevarnost manjša. Pentan, heksan, heptan in oktan so razvrščeni med snovi, ki so nevarne za okolje in škodljive. n-heksan je nevrotoksin. Spojine, bogate s halogeni, so lahko kancerogene.
Glej tudi
urediViri in opombe
uredi- ↑ International Union of Pure and Applied Chemistry. "alkanes". Compendium of Chemical Terminology Internet edition.
- ↑ Meierhenrich, U. (2008). Amino Acids and the Asymmetry of Life. Springer. ISBN 978-3-540-76885-2. http://www.springer.com/chemistry/organic/book/978-3-540-76885-2. Retrieved on 2008-10-18.
- ↑ IUPAC, Commission on Nomenclature of Organic Chemistry (1993). "R-2.2.1: Hydrocarbons". A Guide to IUPAC Nomenclature of Organic Compounds (Recommendations 1993). Blackwell Scientific. http://www.acdlabs.com/iupac/nomenclature/93/r93_184.htm. Retrieved on 2007-02-12.
- ↑ William Reusch. "Examples of the IUPAC Rules in Practice". Virtual Textbook of Organic Chemistry.
- ↑ William Reusch. "Nomenclature - Alkanes". Virtual Textbook of Organic Chemistry.
- ↑ Titan: Arizona in an Icebox?, Emily Lakdawalla, 2004-01-21, pridobljeno 28.3.2005.
- ↑ Mumma, M.J. (1996). "Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2 Hyakutake: Evidence for Interstellar Origin". Science 272: 1310. DOI: 10.1126/science.272.5266.1310. PMID 8650540.
- ↑ 8,0 8,1 8,2 Morrison R.T., Boyd R.N. Organic Chemistry (6th ed.). New Jersey: Prentice Hall. ISBN 0-13-643669-2.
- ↑ A Gravity Investigation of the Pitch Lake Of Trinidad And Tobago". Geological Society of Trinidad & Tobago. Pridobljeno 27.5.2008.
- ↑ Roald Hoffmann (2006), Old Gas, New Gas, 94, American Scientist, str. 16–18
- ↑ Milkov, AV (2004). "Global estimates of hydrate-bound gas in marine sediments: how much is really out there?". Earth-Sci Rev. 66(3-4): 183–197. DOI: 10.1016/j.earscirev.2003.11.002.
- ↑ Background and organization Arhivirano 2009-05-04 na Wayback Machine..
- ↑ Biology of the Prokaryotes. 1999. stran 796. ISBN 0-632-05357-7.
- ↑ Hrsg. Falbe J., Regitz M.: Roempp Chemie Lexikon, 9. izdaja, Georg Thieme, Stutgart
- ↑ Thom et al. (21 August 2007) The Scent of the Waggle Dance. PLoS Biology. 5(9), e228 DOI: [1 10.1371/journal.pbio.0050228[1]]
- ↑ Boese R, Weiss HC, Blaser D (1999). "The melting point alternation in the short-chain n-alkanes: Single-crystal X-ray analyses of propane at 30 K and of n-butane to n-nonane at 90 K". Angew Chemie Int Ed 38: 988–992. DOI: <988::AID-ANIE988>3.3.CO;2-S 10.1002/(SICI)1521-3773(19990401)38:7<988::AID-ANIE988>3.3.CO;2-S
- ↑ Statistična zmes: propan ima dva primarna in en sekundarni ogljikov atom, torej bi morala biti tudi primarni in sekundarni halogenpropan v razmerju 2:1 oziroma 33 % in 67 %.