Etanojska kislina
| Članek zaradi preverljivosti potrebuje dodatne sklice. |
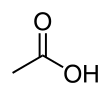
Ocetna kislina (pravilneje etanojska kislina, formula CH3COOH) je organska kislina. Je pomembna sestavina navadnega kisa, vsebuje je okoli 5–15 %. Njene soli se imenujejo acetati. Brezvodna ocetna kislina se imenuje tudi ledocet, saj že pri temperaturi pod 16,7 °C tvori ledu podobne kristale.
| |||
| |||

| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime | |||
| Sistematično ime
etanojska kislina | |||
| Druga imena | |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| 3DMet | |||
| Kratice | AcOH | ||
| 506007 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| ECHA InfoCard | 100.000.528 | ||
| EC število |
| ||
| Število E | E260 (konzervansi) | ||
| Gmelin | 1380 | ||
| KEGG | |||
| MeSH | Acetic+acid | ||
PubChem CID
|
|||
| RTECS število |
| ||
| UNII | |||
| UN število | 2789 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| C2H4O2 | |||
| Molska masa | 60,05 g·mol−1 | ||
| Videz | brezbarvna tekočina | ||
| Vonj | oster, podoben kisu | ||
| Gostota | 1,049 g cm-3 | ||
| Tališče | 16 °C; 61 °F; 289 K | ||
| Vrelišče | 118 °C; 244 °F; 391 K | ||
| z vodo se meša v vseh razmerjih | |||
| log P | -0,322 | ||
| Kislost (pKa) | 4,76 | ||
| Bazičnost (pKb) | 9,198 (bazičnost acetatnega iona) | ||
| Lomni količnik (nD) | 1,371 | ||
| Viskoznost | 1,22 mPa s | ||
| Dipolni moment | 1,74 D | ||
| Termokemija | |||
| Specifična toplota, C | 123,1 J K-1 mol-1 | ||
| Standardna molarna entropija S |
158,0 J K-1 mol-1 | ||
Std tvorbena
entalpija (ΔfH⦵298) |
-483,88--483,16 kJ mol-1 | ||
Std sežigna
entalpija (ΔcH⦵298) |
-875,50--874,82 kJ mol-1 | ||
| Nevarnosti | |||
| GHS piktogrami |  
| ||
| Opozorilna beseda | Pozor | ||
| H226, H314 | |||
| P280, P305+351+338, P310 | |||
| NFPA 704 (diamant ognja) | |||
| Plamenišče | 40 °C (104 °F; 313 K) | ||
| Meje eksplozivnosti |
4-16% | ||
| Smrtni odmerek ali koncentracija (LD, LC): | |||
LD50 (srednji odmerek)
|
3,31 g kg-1, oralno (podgana) | ||
| Sorodne snovi | |||
| Sorodno karboksilne kisline | mravljinčna kislina butanojska kislina | ||
| Sorodne snovi | acetaldehid acetamid | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Ocetna kislina je poleg vode glavna sestavina kisa in ima izrazito kisel okus ter oster vonj. Čeprav je razvrščena med šibke kisline je koncentrirana ocetna kislina jedka. Ocetna kislina je ena od najpreprostejših karboksilnih kislin. Uporabljajo jo v industriji pri proizvodnji celuloznega acetata predvsem za fotografske filme in lopila za les. V gospodinjstvih se razredčena ocetna kislina pogosto uporablja za odstranjevanje vodnega kamna, v živilski industrijipa se jo uporablja kot aditiv za živila z oznako E260, kot regulator kislosti in kot začimbo. Svetovno povpraševanje po ocetni kislini je okrog 6,5 milijona ton na leto od tega približno 1,5 milijonov ton / a jo pridobijo z recikliranjem, preostanek je izdelajo iz petrokemične surovine.
Zgodovina
urediKis je bil znan že v civilizaciji, kot naravna posledica izpostavljenosti piva in vina na zraku. Uporaba ocetne kisline v alkimiji sega v 3. stoletje pred našim štetjem, ko je grški filozof Theophrastus opisal, kako se je kis odzval na kovino, uporabljali so ga tudi za proizvodnjo pigmentov v umetnosti. Stari Rimljani so kuhali kislo vino in tako dobili zelo sladek sirup imenovan Sapa. Sapa je bila bogata s svinčevim acetatom (sladko snovjo) imenovano tudi sladkor iz svinca ali sladkorjev Saturn. To so uporabljali za zastrupitve rimskih aristokratov.
V 8. stoletju je bil Jabir Ibn Hayyan (Geber) prvi, ki se je osredotočil na ocetno kislino iz kisa prek destilacije. V renesansi je ocetno kislino pripravljal skozi suho destilacijo nekaterih kovinskih acetatov.
Kemijske lastnosti
urediKislost
urediVodikov atom se v karboksilni skupini (-COOH) karboksilne kisline loči od ocetne kisline z ionizacijo molekule:
CH3CO2H → CH3CO2- + H+
Zaradi tega se sprošča proton (H +) ocetne kisline, ki ji da kisel značaj. Ocetna kislina je šibka kislina v vodni raztopini ima vrednost pKa 4,75, njena konjugirana baza je acetat (CH3COO-).1,0 M raztopina (koncentracija domačega kisa), ima pH vrednost 2,4.
Glej tudi
urediSklici
uredi- ↑ Scientific literature reviews on generally recognized as safe (GRAS) food ingredients. National Technical Information Service. 1974. str. 1.
- ↑ Chemistry. Encyclopedia Britannica. 5. del. 1961. str. 374.
- ↑ A Guide to IUPAC Nomenclature of Organic Compounds (Recommendations 1993). IUPAC, Commission on Nomenclature of Organic Chemistry (1993). Table 28(a). Carboxylic acids and related groups. Unsubstituted parent structures. Blackwell Scientific publications. ISBN 0-632-03488-2.
- ↑ Acetic Acid - PubChem Public Chemical Database. The PubChem Project. USA: National Center for Biotechnology Information.
Viri
uredi- C. Hosea, R.S. Tanke, G.P. Torrence. Acetic Acid. Ullmann's Encyclopedia of Industrial Chemistry. 2005. Wiley-VCH, Weinheim. doi: 10.1002/14356007.a01_045
- W.L.F. Armarego, C. Chai (2009). Purification of Laboratory Chemicals. 6. izdaja. Butterworth-Heinemann. ISBN 1-85617-567-7.
- G.M. Geoffrey (1917). Industrial and Manufacturing Chemistry. 1. del. London: Crosby Lockwood. str. 330–331.
- P. A. Adet (1798). Mémoire sur l'acide acétique. Annales de Chemie 27. str. 299-319.
- H. Goldwhite (september 2003). Short summary of the career of the German organic chemist, Hermann Kolbe Arhivirano 2009-09-29 na Wayback Machine.. New Haven Section Bull. Am. Chem. Soc. 20 (3).