Metionin
Metionin (okrajšano Met ali M; kodira ga kodon AUG) je α-amino kislina, ki se uporablja v biosintezi proteinov. Vsebuje α-amino skupino (ki je v bioloških pogojih v protonirani obliki −NH3+), an α-karboksilno kislinsko skupino (ki je v bioloških pogojih v deprotonirani obliki −COO−), in pa S-metil tioetersko stransko verigo, ki jo razvršča med nepolarne, alifatske amino kisline. Metikonin je za ljudi esencialna aminokislina, kar pomeni, da je naša presnova ne more sintetizirati - zanjo smo odvisni od prehrane. Metionin je kodiran kot AUG, kar je koda za začetni kodon, začetek genetske kode za protein; tako je tudi prva aminokislina v nastajajočem polipeptidu med prevajanjem informacijske RNK (mRNA).[3]
 kanonična oblika metionina
| |
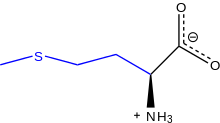 Cviterionska oblika L-metionina
| |
| Imena | |
|---|---|
| IUPAC ime
mationin
| |
| Druga imena
2-amino-4-(metiltio)butanojska kislina
| |
| Identifikatorji | |
3D model (JSmol)
|
|
| Kratice | Met, M |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.000.393 |
| EC število |
|
| KEGG | |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti[2] | |
| C5H11NO2S | |
| Molska masa | 149,21 g·mol−1 |
| Videz | White crystalline powder |
| Gostota | 1.340 g/cm3 |
| Tališče | 281 °C (538 °F; 554 K) decomposes |
| Soluble | |
| Kislost (pKa) | 2.28 (carboxyl), 9.21 (amino)[1] |
| Farmakologija | |
| V03AB26 (WHO) QA05BA90, QG04BA90 | |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Metionin: proteinogenska amino kislina
urediSkupaj s cisteinom predstavlja metionin ena od obeh proteinogenskih aminokislin, ki vsebujeta žveplo. Razen v redkih izjemah, kjer deluje kot redoks čutilo (npr. [4]), metioninski residui nimajo katalitične vloge.[5] To je v nasprotju z rezidui cisteina, kjer igra tiol skupina katalitično vlogo v številnih proteinih. Tioeter pa s svojim stabilizirajočo S/π interakcijo med atomom žvepla v stranski verigi in aromatskimi amino kislinami igra vlogo v eni tretjini poznanih proteinskih struktur. Da je ta vloga manj pomembna, je videti iz dejstva, da zamenjava metionina z norlevcinom, amino kislino z ravno ogljikovodikovo stransko verigo brez tioetra, nima kakega občutnega učinka.[6] Domnevno je v zgodnjih različicah genetske kode bil prisoten norlevcin, vendar ga je metionin iz končne različice genetskega koda izrinil, ker se uporablja v kofaktorju S-adenozil metioninu (SAM).[7] Ta situacija ni enkratna, lahko da je do nje prišlo tudi pri ornitinu in argininu.[8]
Kodiranje
urediMetionin je ena od samo dveh aminokislin, ki ju kodira en sam kodon (AUG, druga aminokislina te vrste je triptofan s kodonom UGG). Gledano z razvojnega vidika drugi kodoni vrste AU? kodirajo izolevcin, ki je ravno tako hidrofobna amino kislina. V genomu mitohondrijev je pri več organizmih, kot so med drugim metazoa in kvasovke, metionin kodiran tudi z AUA. V standardnem genetskem kodu AUA kodira izolevcin, ustrezna tRNA (ileX v Escherichia coli) pri tem uporablja neobičajno bazo lizidin (bakterije) ali agmatin (arheje) , da lahko kodon razlikuje od AUG.[9][10]
Kodon AUG za metionin je tudi najbolj pogost začetni kodon. "Start" kodon je sporočilo za ribozom, da začne s prevajanjem informacijske RNK. Zaradi tega je pri evkariontih in arheah pogosto na N-terminalu proteinske verige najti metionin. Pri bakterijah se kot začetna aminokislina uporablja izpeljanka N-formilmetionin.
Človeška prehrana - viri
urediVisoke vsebnosti metionina je najti v jajcih, sezamovem semu, brazilskih oreščkih, ribah, mesu in nekaterih drugih rastlinskih semenih; metionin najdemo tudi v žitnih zrnih. Večina sadja in zelenjave ga vsebuje zelo malo. Tudi večina stročnic ima malo metionina. Vendar pa je kombinacija metionina in cisteina skrbi za popolnost proteina..[11] Včasih se hrani za živali dodaja racemični metionin.[12]
Zdravje
urediIzguba metionina je bilo povezana s senilnim staranjem las. Pomanjkanje metionina vodi do kopičenja vodikovega peroksida v lasnih mešičkov, zmanjšane učinkovitosti tirozinaze in postopnega razbarvanja las.[13] Metionin je intermediat v biosintezi cisteina, karnitina, tavrina, lecitina, fosfatidilholina in drugih fosfolipidov. Nepravilna pretvorba metionina lahko vodi do ateroskleroze.[14]
Sklici
uredi- ↑ Dawson, R.M.C.; in sod. (1959). Data for Biochemical Research. Oxford: Clarendon Press.
- ↑ Predloga:RubberBible62nd.
- ↑ Guedes, R. L.; Prosdocimi, F; Fernandes, G. R.; Moura, L. K.; Ribeiro, H. A.; Ortega, J. M. (2011). »Amino acids biosynthesis and nitrogen assimilation pathways: A great genomic deletion during eukaryotes evolution«. BMC Genomics. 12 Suppl 4: S2. doi:10.1186/1471-2164-12-S4-S2. PMC 3287585. PMID 22369087.
- ↑ Bigelow, D. J.; Squier, T. C. (2005). »Redox modulation of cellular signaling and metabolism through reversible oxidation of methionine sensors in calcium regulatory proteins«. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1703 (2): 121–34. doi:10.1016/j.bbapap.2004.09.012. PMID 15680220.
- ↑ Ferla, M. P.; Patrick, W. M. (2014). »Bacterial methionine biosynthesis«. Microbiology. 160 (Pt 8): 1571–84. doi:10.1099/mic.0.077826-0. PMID 24939187.
- ↑ Cirino, P. C.; Tang, Y; Takahashi, K; Tirrell, D. A.; Arnold, F. H. (2003). »Global incorporation of norleucine in place of methionine in cytochrome P450 BM-3 heme domain increases peroxygenase activity«. Biotechnology and Bioengineering. 83 (6): 729–34. doi:10.1002/bit.10718. PMID 12889037.
- ↑ Alvarez-Carreño, C; Becerra, A; Lazcano, A (2013). »Norvaline and norleucine may have been more abundant protein components during early stages of cell evolution«. Origins of Life and Evolution of Biospheres. 43 (4–5): 363–75. doi:10.1007/s11084-013-9344-3. PMID 24013929.
- ↑ Jukes, T. H. (1973). »Arginine as an evolutionary intruder into protein synthesis«. Biochemical and Biophysical Research Communications. 53 (3): 709–14. doi:10.1016/0006-291x(73)90151-4. PMID 4731949.
- ↑ Ikeuchi, Y; Kimura, S; Numata, T; Nakamura, D; Yokogawa, T; Ogata, T; Wada, T; Suzuki, T; Suzuki, T (2010). »Agmatine-conjugated cytidine in a tRNA anticodon is essential for AUA decoding in archaea«. Nature Chemical Biology. 6 (4): 277–82. doi:10.1038/nchembio.323. PMID 20139989.
- ↑ Muramatsu, T; Nishikawa, K; Nemoto, F; Kuchino, Y; Nishimura, S; Miyazawa, T; Yokoyama, S (1988). »Codon and amino-acid specificities of a transfer RNA are both converted by a single post-transcriptional modification«. Nature. 336 (6195): 179–81. doi:10.1038/336179a0. PMID 3054566.
- ↑ Finkelstein JD (1990). »Methionine metabolism in mammals«. J. Nutr. Biochem. 1 (5): 228–237. PMID 15539209.
- ↑ Liz Palika. New York: Howell Book House. 1996. ISBN 0-87605-467-X.
- ↑ Wood, J.M.; in sod. (Julij 2009). »Senile hair graying: H2O2-mediated oxidative stress affects human hair color by blunting methionine sulfoxide repair«. FASEB Journal. 23 (7): 2065–75. doi:10.1096/fj.08-125435. PMID 19237503.
- ↑ Refsum H; Ueland PM; Nygård O; Vollset SE (1998). »Homocysteine and Cardiovascular Disease«. Annual Review of Medicine. 49 (1): 31–62. doi:10.1146/annurev.med.49.1.31. PMID 9509248.
Zunanje povezave
uredi- Rudra, M. N.; Chowdhury, L. M. (30. september 1950). »Methionine Content of Cereals and Legumes«. Nature. 166 (568): 568. Bibcode:1950Natur.166..568R. doi:10.1038/166568a0.