Imidazol
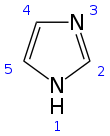
Imidazol je organska spojina s formulo C3N2H4. Je bela ali brezbarvna vodotopna trdnina, ki daje rahlo alkalno raztopino. V kemiji je aromatski heterocikel, ki spada med diazole in ima nesosednja dušikova atoma.
| |||
| |||

| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
1H-Imidazol
| |||
| Druga imena
1,3-diazol
glioksalin (arhaično) 1,3-diazaciklopenta-2,4-dien | |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.005.473 | ||
| EC število |
| ||
| KEGG | |||
PubChem CID
|
|||
| RTECS število |
| ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| C3H4N2 | |||
| Molska masa | 68,077 g/mol | ||
| Videz | White or pale yellow solid | ||
| Gostota | 1,23 g/cm3, solid | ||
| Tališče | 89 do 91 °C (192 do 196 °F; 362 do 364 K) | ||
| Vrelišče | 256 °C (493 °F; 529 K) | ||
| 633 g/L | |||
| Kislost (pKa) | 6,95 ([[konjugirano kislino]konjugirana kislina]]) [1] | ||
| λmax | 206 nm | ||
| Struktura | |||
| Kristalna struktura | monoclinic | ||
| Koordinacijska geometrija |
planar 5-membered ring | ||
| Dipolni moment | 3.61 D | ||
| Nevarnosti | |||
| Glavne nevarnosti | Corrosive | ||
| Varnostni list | External MSDS | ||
| R-stavki (zastarelo) | R20 R22 R34 R41 | ||
| S-stavki (zastarelo) | S26 S36 S37 S39 (S45) | ||
| Plamenišče | 146 °C (295 °F; 419 K) | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Veliko naravnih spojin, še posebej alkaloidi, vsebujejo imidazolni obroč. Ti imidazoli imajo skupni 1,3-C3N2 obroč, ampak z različnimi substituenti. Ta obročni sistem je prisoten v pomembnih bioloških gradnikih, kot so histidin in sorodni hormon histamin. Veliko zdravil vsebuje imidazolni obroč, kot na primer nekateri antimikotiki, nitroimidazolni antibiotiki in pomirjevalo midazolam.[2][3][4][5][6]
Ko se imidazol kondenzira s pirimidinskim obročem, nastane purin, ki je najpogosteje pojavljajoči dušik vsebujoči heterocikel v naravi.[7]
Ime "imidazol" je leta 1887 skoval nemški kemik Arthur Rudolf Hantzsch (1857–1935).[8]
Glej tudi
urediReference
uredi- ↑ Walba, H.; Isensee, R. W. (1961). »Acidity constants of some arylimidazoles and their cations«. J. Org. Chem. 26 (8): 2789–2791. doi:10.1021/jo01066a039.
- ↑ Karitzky, A. R.; Rees (1984). Comprehensive Heterocyclic Chemistry. Zv. 5. str. 469–498.
- ↑ Grimmett, M. Ross (1997). Imidazole and Benzimidazole Synthesis. Academic Press.
- ↑ Brown, E. G. (1998). Ring Nitrogen and Key Biomolecules. Kluwer Academic Press.
- ↑ Pozharskii, A. F.; in sod. (1997). Heterocycles in Life and Society. John Wiley & Sons.
- ↑ Gilchrist, T. L. (1985). Heterocyclic Chemistry. Bath Press. ISBN 0-582-01421-2.
- ↑ Rosemeyer, H. (2004). »The Chemodiversity of Purine as a Constituent of Natural Products«. Chemistry & Biodiversity. Zv. 1, št. 3. str. 361. doi:10.1002/cbdv.200490033.
- ↑ Hantzsch, A. and Weber, J. H. (1887) "Ueber Verbindungen des Thiazols (Pyridins der Thiophenreihe)" (On compounds of thiazole (pyridines of the thiophene series), Berichte der deutschen chemischen Gesellschaft, 20 : 3118–3132, see p. 3119. See also: Hantzsch, A. (1888) "Allegemeine Bemerkungen über Azole" (General observations about azoles), Annalen der Chemie, 249 : 1–6. Hantzsch proposed a reform of the nomenclature of azole compounds, including a proposal to call the heterocyclic ring C3H3(NH)N "imidazole" ; see pp. 2 and 4.