Kalijev karbonat
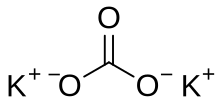
Kalijev karbonat ali pepelika je bela sol s kemijsko formulo K2CO3. Topen je v vodi in netopen v metanolu.[2] Vodna raztopina je zelo alkalna. Nastaja na primer v reakciji kalijevega hidroksida (KOH) z ogljikovim dioksidom (CO2). Je zelo higroskopen, zato je v trdnem stanju pogosto moker. Uporablja se predvsem za proizvodnjo mila in stekla.
| |
| |

| |
| Imena | |
|---|---|
| IUPAC ime
kalijev karbonat
| |
| Druga imena
dikalijev karbonat, pepelika, potaša
| |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.008.665 |
| Število E | E501(i) (sredstva za uravnavanje Ph, ...) |
PubChem CID
|
|
| RTECS število |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| K2CO3 | |
| Molska masa | 138,205 g/mol |
| Videz | bela higroskopna trdnina |
| Gostota | 2,43 g/cm3 |
| Tališče | 891 °C (1.636 °F; 1.164 K) |
| Vrelišče | razpade |
| 112 g/100 mL (20 °C) 156 g/100 mL (100 °C) | |
| Topnost | netopen v etanolu, metanolu in acetonu |
| Nevarnosti | |
| Glavne nevarnosti | |
| R-stavki (zastarelo) | R22 R36 R37 R38 |
| NFPA 704 (diamant ognja) | |
| Plamenišče | ni vnetljiv |
| Smrtni odmerek ali koncentracija (LD, LC): | |
LD50 (srednji odmerek)
|
1870 mg/kg (peroralno, podgana)[1] |
| Sorodne snovi | |
| Drugi anioni | kalijev bikarbonat |
| Drugi kationi | litijev karbonat natrijev karbonat rubidijev karbonat cezijev karbonat |
| Sorodne snovi | amonijev karbonat |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Zgodovina
urediKalijev karbonat je prvi identificiral Antonio Campanella leta 1743. Je glavna sestavina pepelike, ki nastane po kristalizaciji lužine lesnega pepela in vinskega kamna. V preteklosti so ga proizvajali s praženjem pepelike v plavžu, kamor so jo dodajali za odstranjevanje nečistoč. Fin bel ostanek so imenovali biserni pepel. Postopek za pridobivanje kalijevega karbonata je izboljšal in leta 1790 patentiral iznajditelj Samuel Hopkins iz Filadelfije.
Sodobna proizvodnja
urediKalijev karbonat se proizvaja industrijsko z elektrolizo kalijevega klorida. Med elektrolizo nastane kalijev hidroksid, ki se nato z ogljikovim dioksidom pretvori v kalijev karbonat:
- elektroliza: 2KCl → 2K + Cl2
- 2K + 2H2O → 2KOH + H2
- 2KOH + CO2 → K2CO3 + H2O
Uporaba
urediV preteklosti se je uporabljal za proizvodnjo mila, stekla in porcelana.
Je blago sušilno sredstvo, ki se uporablja v primerih, ko druga sušilna sredstva, na primer kalcijev klorid in magnezijev sulfat, niso uporabna. Za kisle spojine ni primeren, primeren pa je za sušenje organskih reakcijskih zmesi, v katerih ena od komponent vsebuje nekaj kislih nečistoč. Primeren je tudi za sušenje nekaterih ketonov, alkoholov in aminov pred destilacijo.[3]
V azijski kuhinji se uporablja za pripravo priljubljenega travnega želeja, v Nemčiji pa pogosto namesto pecilnega praška za peko ingverjevega kruha in peciva.
V proizvodnji kakava v prahu se uporablja kot sredstvo za zmanjšanje kislosti kakavovih semen, ki hkrati poudari kakavovo aromo. Postopek je leta 1828 razvil Nizozemec Coenrad Johannes van Houten.
V proizvodnji medice in vina se včasih uporablja kot pufer.
Kalijev karbonat je tudi sredstvo za mehčanje trde vode.[4]
Uporablja se tudi kot sredstvo za gašenje požara, pripravo spajk in prehranski dodatek za živino in piščance, s katerim se uravnava potrebe živali po kaliju.
Sklici
uredi- ↑ Potassium carbonate. Toxnet. Pridobljeno 21. februarja 2015.
- ↑ A.V Kurzin (2002). Solubility of Potassium Carbonate and Potassium Hydrocarbonate in Methanol. Journal of Chemical & Engineering Data 47 (5). DOI: 10.1021/je020012v.
- ↑ J. Leonard, B. Lygo, G. Procter (1998). Advanced Practical Organic Chemistry. Stanley Thomas Publishers Ltd.
- ↑ L.M. Child (1832). The American Frugal Housewife.
