Kalcijev hidrogensulfit
Kalcijev bisulfit ali kalcijev hidrogensulfit je anorganska spojina, ki je sol kalcijevega kationa in bisulfitnega aniona. Pripravimo ga lahko z obdelavo apna s presežkom žveplovega dioksida in vode. Spojina je s kodo E227 uporabljena tudi kot konzervans. Kalcijev bisulfit je kisla sol in se v vodni raztopini obnaša kot kislina. Uporablja se v sulfitnem postopku za proizvodnjo papirja iz lesnih sekancev.[1]
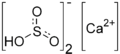
| |

| |
| Imena | |
|---|---|
| IUPAC ime
Kalcijev hirogensulfit
| |
Druga imena
| |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChemSpider | |
| ECHA InfoCard | 100.034.007 |
| Število E | E227 (konzervansi) |
PubChem CID
|
|
| RTECS število |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| Ca(HSO3)2 | |
| Molska masa | 202,22 g/mol |
| Tališče | 203 °C |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Sinteza
urediKalcijev bisulfit lahko pripravimo z obdelavo apna (Ca(OH)2) s presežkom žveplovega dioksida in vode.[2] Med sintezo bo snov v obliki vodne raztopine imela rumenozelene barve.[3]
- CaCO3 + 2H2SO3 → Ca(HSO3)2 + H2O + CO2
Kemične reakcije
urediPri prebavi kalcijevega bisulfita kot prehranskega dodatka lahko pride do različnih reakcij v presnovnih poteh. Pri eni od pogostih izidov pride do reakcije, pri kateri nastane 6–8 % žveplovega dioksida. Ta lahko v pljučih preide v sulfit, v jetrih pa se lahko pretvori v sulfat s pomočjo sulfit oksidaze. Sulfit je lahko škodljiv za ljudi z astmo. Sulfit lahko povzroči tudi utikarijo in angioedem pri sicer zdravih posameznikih.[3]
Oksidacija kalcijevega bisulfita, pri čemer nastane sulfat, je tudi eden izmed korakov razžvepljanja.[4] Ko ta reakcija poteka v vodni raztopini, nastane mavec, hitrost reakcije pa povečuje magnezijev (II) sulfat.[5]
Drugi katalizatorji za oksidacijo kalcijevega bisulfita so mangan, železo, kobalt, nikelj, svinec in cink.[2]
Uporaba
urediKalcijev bisulfit je ena od kemikalij za povečanje učinkovitosti pridobivanja sladkorja pri predelavi lesnih presežkov v biogorivo in letalsko gorivo. Uporaba blagega bisulfita poveča donos in tudi prihrani stroške pri prevozu lesa v obrate za proizvodnjo etanola.[6]
Kalcijev bisulfit se pogosto uporablja tudi kot živilski konzervans, npr. za soljenje češenj, vendar raziskave kažejo, da lahko nekateri mikroorganizmi zaradi sinteze encima poligalakturonaza, ki deluje tudi v prisotnosti kalcijevega hidrogensulfata, povzročijo gnitje češenj. Tri vrste glivic, ki še posebej povzročajo gnitje soljenih češenj, so Aspergillus niger, Cytospora leucostoma in Penicillium expansum.[7]
Raztopina kalcijevega bisulfita se uporablja pri pretvorbi dihidrokercetina v pulpi drevesnega lubja, nato pa se dihidrokercetin pretvori v uporaben kvercetin. Kalcijev bisulfit ni optimalna bisulfitna spojina za to reakcijo, saj lahko odstranitev kalcijevih ionov iz raztopine zavira reakcijo. Kalcijevi bisulfiti imajo pri tej reakciji, tako kot drugi bisulfiti, kot je dušikov bisulfit, pri tej reakciji katalitično sposobnost, saj se ne porabijo in jih je mogoče ponovno uporabiti.[8]
Sklici
uredi- ↑ Patt, Rudolf; Kordsachia, Othar; Süttinger, Richard; Ohtani, Yoshito; Hoesch, Jochen F.; Ehrler, Peter; Eichinger, Rudolf; Holik, Herbert; Hamm (2000). »Paper and Pulp«. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a18_545.
- ↑ 2,0 2,1 Karatza, Despina; Prisciandaro, Marina; Lancia, Amedeo; Musmarra, Dino (1. junij 2010). »Sulfite Oxidation Catalyzed by Cobalt Ions in Flue Gas Desulfurization Processes«. Journal of the Air & Waste Management Association. 60 (6): 675–680. doi:10.3155/1047-3289.60.6.675. ISSN 1096-2247. PMID 20564992. S2CID 9127556.
- ↑ 3,0 3,1 EFSA Panel on Food additives and Nutrient Sources added to Food (ANS) (2016). »Scientific Opinion on the re-evaluation of sulfur dioxide (E 220), sodium sulfite (E 221), sodium bisulfite (E 222), sodium metabisulfite (E 223), potassium metabisulfite (E 224), calcium sulfite (E 226), calcium bisulfite (E 227) and potassium bisulfite (E 228) as food additives«. EFSA Journal. 14 (4). doi:10.2903/j.efsa.2016.4438 – prek wiley.com.
- ↑ Dagmar Wiechoczek (26. marec 2010). »Technologien zur Verhinderung von Schwefelemissionen«. Pridobljeno 5. junija 2022.
- ↑ Lancia, Amedeo; Musmarra, Dino; Prisciandaro, Marina; Tammaro, Marco (1. julij 1999). »Catalytic oxidation of calcium bisulfite in the wet limestone–gypsum flue gas desulfurization process«. Chemical Engineering Science (v angleščini). 54 (15): 3019–3026. Bibcode:1999ChEnS..54.3019L. doi:10.1016/S0009-2509(98)00483-7. ISSN 0009-2509.
- ↑ Dwight Anderson and, Johnway Gao (2015). »Mild Bisulfite Pretreatment of Forest Residuals« (PDF).[mrtva povezava]
- ↑ Lewis JC, Pierson CF, Powers MJ (1963). »Fungi Associated with Softening of Bisulfite-Brined Cherries«. Applied and Environmental Microbiology. 11 (2): 93–99. doi:10.1128/am.11.2.93-99.1963. PMC 1057949. PMID 16349630. S2CID 9370969 – prek ASM Journals.
- ↑ Kurth, Ervin (1953). »Quercetin from Fir and Pine Bark«. Industrial & Engineering Chemistry. 45 (9): 2096–2097. doi:10.1021/ie50525a047. Pridobljeno 29. marca 2023.