Kalijev ferat
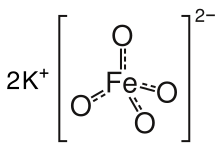
Kalijev ferat je kemijska spojina s formulo K2FeO4. Je škrlatna paramagnetna sol in redek primer železove(IV) spojine. Železo je v večini spojin v oksidacijskih stanjih +2 ali +3 (Fe2+ ali Fe3+). Feratni ion FeO2−
4 je zaradi visokega oksidacijskega stanja močan oksidant.
| |

| |
| Imena | |
|---|---|
| IUPAC ime
kalijev ferat(VI)
| |
| Druga imena
dikalijev ferat
| |
| Lastnosti | |
| K2FeO4 | |
| Molska masa | 198,0392 g/mol |
| Videz | temno škrlatna trdnina |
| Gostota | 2,829 g/cm3, trden |
| Tališče | >198 °C (temperatura razpada) |
| topen v 1M KOH | |
| Topnost (druga topila) | z večino topil reagira |
| Struktura | |
| Kristalna struktura | ortorombska |
| Koordinacijska geometrija |
tetraedrična |
| Dipolni moment | 0 D |
| Nevarnosti | |
| Glavne nevarnosti | oksidant |
| R-stavki (zastarelo) | 8 |
| S-stavki (zastarelo) | 17-36 |
| Plamenišče | ni vnetljiv |
| Sorodne snovi | |
| Drugi anioni | kalijev manganat kalijev kromat K2RuO4 |
| Drugi kationi | BaFeO4 Na2FeO4 |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
K2FeO4 je zanimiv za aplikacije v »zeleni kemiji«, ker so stranski produkti njegove rabe, železovi oksidi, za okolje neškodljivi. Sorodni oksidanti, na primer kromati, se obravnavajo kot nevarni za okolje. Glavna težava pri njegovi uporabi je njegova, pogosto prevelika, reaktivnost, ki se kaže v razpadu v stiku z vodo:[1]
- 4 K2FeO4 + 4 H2O → 3 O2 + 2 Fe2O3 + 8 KOH
Sinteza in zgradba
urediKalijev ferat je prvi odkril nemški kemik, zdravnik in filozof Georg Ernst Stahl (1660 – 1734) v ostanku zgorevanja kalijevega nitrata (solitra) in železovega prahu. Vodna raztopina ostanka se je škrlatno obarvala. Francoski kemik Edmond Frémy (1814 – 1894) je kasneje odkril, da med taljenjem kalijevega hidroksida in železovega(III) oksida na zraku nastane snov, topna v vodi. Kemijska sestava spojine je ustrezala kalijevemu manganatu:
- Fe + 3 KNO3 + 2 KOH → K2FeO4 + 3 KNO2 + H2O }
Natrijev ferat nastaja tudi z elektrolizo koncentriranega KOH z železno elektrodo:
- Fe + 2KOH + 2 H2O → K2FeO4 + 3H2
V laboratoriju se pripravlja z oksidacijo alkalne raztopine železovih(III) soli s koncentriranim natrijevim hipokloritom:[2]
- Fe2O3 + 3 Cl2 + 10 KOH → 2 K2FeO4 + 6 KCl + 5 H2O
Sol ima enako strukturo kot K2MnO4, K2SO4 in K2CrO4. Trdna sol je zgrajena iz tetraedričnih anionov FeO2−
4 in kationov K+. Razdalja Fe-O je 1,66 Å.[3] Znan je tudi slabo topen barijev ferat BaFeO4.
Lastnosti in uporaba
urediTrden K2SO4 je stabilen. Njegova temno škrlatna barva je podobna barvi kalijevega permanganata (KMnO4). Vodne raztopine so pri visokih pH stabilne, v vodi, še zlasti v nakisani, pa hidrolizira, pri čemer se sprošča kisik:
- 4 K2FeO4 + 6 H2O → FeO(OH) + 8 KOH + 3 O2
Med segrevanjem na 500-700 ºC razpade:
- 2 K2FeO4 → K3FeO4 + KFeO2 + O2
Z razredčenimi kislinami tvori ustrezne soli, z žveplovo kislino sulfate):
- 4 K2FeO4 + 10 H2SO4 → 2 Fe2(SO4)3 + 4 K2SO4 + 3 O2 + 10 H2O
Med taljenjem z alkalijami razpada:
- 4 K2FeO4 + 4 KOH → 4 K3FeO4 + O2 + H2O
Kalijev ferat je, tako kot drugi ferati, močan oksidant, močnejši od KMnO4:
- 4 K2FeO4 + 3 Cr(OH)2 → 4 FeO(OH) + 3 K2CrO4 + 2 KOH
Stranski produkt redoks reakcij je rji podobna zmes okolju nenevarnih železovih oksidov, zato se K2FeO4 obravnava kot »zeleni oksidant«. Pri obdelavi odpadnih voda se uporablja za oksidacijo organskih nečistoč in biocid. Nastali železov(III) oksihidroksid je odličen flokulant.
Reagira tudi v substitucijskih reakcijah:
- K2FeO4 + BaCl2 → BaFeO4•H2O + 2 KCl
V organskih sintezah se uporablja za oksidacijo primarnih alkoholov.[4] Kalijev ferat bi lahko bil tudi depolarizator (katoda) v reverzibilni »super železovi bateriji«.
Viri
uredi- ↑ Holleman, A. F.; in sod. (2001). Inorganic Chemistry (1 izd.). San Diego [etc.] : Academic Press ; Berlin ; New York : De Gruyter, cop. COBISS 24318981. ISBN 0-12-352651-5.
- ↑ J.M. Schreyer, G.W. Thompson, L.T. Ockerman. Potassium Ferrate(VI). Inorganic Syntheses IV (1953): 164-168.
- ↑ M. L. Hoppe, E.O. Schlemper, R.K. Murmann (1982). Structure of Dipotassium Ferrate(VI). Acta Crystallographica B38: 2237-2239. doi: 10.1107/S0567740882008395.
- ↑ J.R. Green. Potassium Ferrate. Encyclopedia of Reagents for Organic Synthesis 2001. John Wiley. doi: 10.1002/047084289X.rp212.