Divodikov trioksid
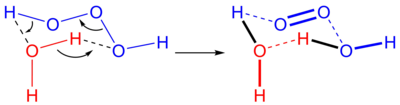
Divodikov trioksid (tudi vodikov trioksid ali trioksidan) je nestabilna molekula s formulo H2O3 ali HOOOH. Spada v skupino vodikovih polioksidov.[2] V vodnih raztopinah vodikov trioksid razpade na vodo in kisik. Obratna reakcija, adicija singletnega kisika k molekuli vode, običajno ne poteče zaradi tega, ker singletni kisik ni stabilen in se relativno redko tvori. Drugače je v bioloških sistemih, kjer je znano, da se ozon tvori iz singletnega kisika.[3]
| Imena | |
|---|---|
| IUPAC ime
Trioksidan[1]
| |
| Druga imena
Divodikov trioksid
| |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| Gmelin | 200290 |
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| H2O3 | |
| Molska masa | 50,01 g·mol−1 |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |

Priprava
urediDivodikov trioksid se lahko pridobi v majhnih, toda zaznavnih količinah z reakcijo ozona in vodikovim peroksidom, ali z električno disociacijo vode. Večje količine se lahko pripravijo z reakcijo ozona z organskimi reducenti pri nizkih temperaturah z raznimi organskimi raztopinami.
Reakcija ozona z vodikovim peroksidom je znana kot »Peroksonov proces«. Ta mešanica se uporablja že nekaj časa za razkuževanje podzemne vode onesnažene z organskimi spojinami. Reakcija proizvaja H2O5.[navedi vir]
Struktura
urediV letu 2005 so trioksidan eksperimentalno detektirali z mikrovalovno spektroskopijo. Spektroskopske analize so pokazale da ima molekula linearno nagnjeno strukturo H-O-O-O-H, s krajšo O-O vezjo, kot pri vodikovem peroksidu. Prav tako je trioksidan rahlo bolj kisel od vodikovega peroksida.[4]
Reakcije
urediVodikov trioksid v organskih topilih pri sobni temperaturi hitro razpade v vodo in kisik, z razpolovno dobo približno 16 minut, v vodi pa razpade v nekaj milisekundah.
Glejte tudi
urediViri
uredi- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. str. 1024. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ↑ Cerkovnik, J.; Plesničar, B. (2013). »Recent Advances in the Chemistry of Hydrogen Trioxide (HOOOH)«. Chem. Rev. 113: 7930–7951. doi:10.1021/cr300512s. PMID 23808683.
- ↑ Nyffeler, P.T.; Boyle, N.A.; Eltepu, L.; Wong, C.-H.; Eschenmoser, A.; Lerner, R.A.; Wentworth Jr., P. (2004). »Dihydrogen Trioxide (HOOOH) Is Generated during the Thermal Reaction between Hydrogen Peroxide and Ozone«. Angew. Chem. Int. Ed. 43: 4656–4659. doi:10.1002/anie.200460457. PMID 15317003.
- ↑ Suma, K.; Sumiyoshi, Y.; Endo, Y. (2005). »The Rotational Spectrum and Structure of HOOOH«. J. Am. Chem. Soc. 127: 14998–14999. doi:10.1021/ja0556530. PMID 16248618.