Fenantren
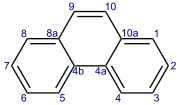
Fenantren je policiklični aromatski ogljikovodik, sestavljen iz treh zlitih benzenovih obročev. Je bel prah z modro fluorescenco. Njegovo ime je sestavljeno iz imen fenil in antracen. V čisti obliki je v cigaretnem dimu. Znan je po tem, da draži kožo in jo naredi občutljivo na sončno svetlobo. Fenantren je bel prah z modro fluorescenco.
| |

| |

| |
| Imena | |
|---|---|
| IUPAC imes
fenantren,
triciklo[8.4.0.02,7]tetradeka-1,3,5,7,9,11,13-heptaene | |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
| ECHA InfoCard | 100.001.437 |
| EC število |
|
| KEGG | |
| MeSH | C031181 |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| C14H10 | |
| Molska masa | 178,23 g·mol−1 |
| Videz | brezbarvna trdnina |
| Gostota | 1,18 g/cm3[1] |
| Tališče | 101 °C (214 °F; 374 K) |
| Vrelišče | 332 °C (630 °F; 605 K) |
| 1,6 mg/L[1] | |
| Nevarnosti | |
EU klasifikacija (DSD) (zastarelo)
|
|
| NFPA 704 (diamant ognja) | |
| Plamenišče | 171 °C (340 °F; 444 K) |
| Struktura | |
| C2v[2] | |
| Dipolni moment | 0 D |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Spojina s fenantrenovim ogrodjem in dušikom na položajih 4 in 5 je fenantrolin.
Fenatren tvori tudi ogrodje morfinana, ki je osnova velikega števila psihoaktivnih kemikalij, vključno z antitusiki, opioidnimi analgetiki in disociativnimi halucinogeni.[3]
Lastnosti
urediFenantren ni topen v vodi ampak v večini nizko polarnih organskih topil kot so toluen, ogljikov tetraklorid, eter, kloroform, ocetna kislina in benzen.
Sinteza
urediKlasična metoda za njegovo sintezo je Bardhan-Senguptova sinteza fenentrena:
Prvi korak je elektrofilna aromatska substitucijska reakcija, v kateri difosforjev pentoksid odcepi alkoholno –OH skupino in vodikov atom v obliki vode. V tem koraku ne nastane izven aromatskega obroča nobena nova dvojna vez. V drugem koraku se 9,10-dihidrofenantren dehidrogenira z elementarnim selenom. Mehanizem aromatizacije nasičenega šestčlenskega obroča s pomočjo selena ni znana, vendar v njej nastane vodikov selenid H2Se.
Fenantren se lahko tvori tudi fotokemično iz nekaterih diariletenov.
Reakcije
urediMed reakcije, ki običajno potekajo na 9. in 10. ogljikovem atomu, spadajo:
- oksidacija s kromovo kislino v fenantrenkinon,
- redukcija z vodikom in raney nikljem v 9,10-dihidrofenantren,
- elektrofilno halogeniranje z bromom v 9-bromofenantren,
- aromatska sulfonacija v 2- in 3-fenantrensulfonsko kislino in
- ozonoliza v difenilaldehid.
Stabilnost
urediFenentren je bolj stabilen kot njegov linearni izomer antracen. Klasična in dobro pojasnjena razlaga njegove stabilnosti temelji na Clarovem pravilu. Novejša teorija se sklicuje na tako imenovano stabilizacijo vezi vodik-vodik med atomoma C4 in C5.
Nahajališča
urediAntracen se v naravi pojavlja kot mineral ravatit,[4] ki spada v majhno skupino organskih mineralov. Ravalit se v majhnih količina pojavlja v skladih gorečega premoga.
Februarja 2014 je NASA objavila zelo posodobljeno bazo podatkov za odkrivanje policikličnih aromatskih ogljikovodikov (PAHs) v vesolju, med katerimi je tudi fenantren. Po mnenju znanstvenikov bi lahko bilo več kot 20 % ogljika v vesolju vezanega v PAHs. Ti ogljikovodiki bi lahko bili osnova za nastanek življenja. Zgleda, da so se PAHs začeli tvoriti nekaj milijard let po prapoku in se začeli širiti po vesolju. Povezani so tudi z nastajajočimi zvezdami in zunajosončnimi planeti.[5]
Sklici
uredi- ↑ 1,0 1,1 1,2 1,3 1,4 GESTIS Substance Database. Napaka pri navajanju: Neveljavna oznaka
<ref>; sklici, poimenovaniGESTIS, so definirani večkrat z različno vsebino (glej stran pomoči). - ↑ Peter Atkins, J. D. P., Atkins' Physical Chemistry. Oxford: 2010. Pg.443
- ↑ W. Zhang, J.S. Hong, H.C. Kim, W. Zhang, M.L. Block (2004). Morphinan neuroprotection: new insight into the therapy of neurodegeneration. Critical Reviews in Neurobiology 16 (4): 271–302. PMID 15862109. Pridobljeno 6. maja 2011.
- ↑ Ravatite. Mineral Data.
- ↑ R. Hoover (2014). Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That Arhivirano 2020-05-10 na Wayback Machine.. NASA. Pridobljeno 22. februarja 2014.
