Spektralna črta
Spektralna črta je šibkejše ali močnejše območje v sicer enakomernem in zveznem spektru svetlobe. Spektralna črta je lahko posledica oddajanja ali absorpcije svetlobe v ozkem frekvenčnem območju v primerjavi z bližnjimi frekvencami. Spektralne črte se pogosto uporabljajo za identifikacijo atomov in molekul. Te "prstne odtise" je mogoče primerjati s predhodno zbranimi "prstnimi odtisi" izbranih atomov[1] in molekul [2] in jih uporabiti za identifikacijo atomskih in molekularnih komponent zvezd in planetov, kar bi bilo sicer nemogoče.
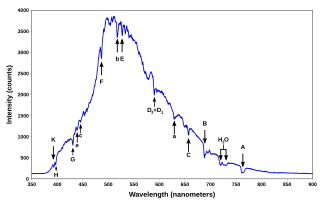
Vrste črtastih spektrov uredi
Spektralna črta je rezultat interakcije med fotonom in kvantnim sistemom, običajno atoma, včasih tudi molekule ali atomskega jedra. Če ima foton približno pravo količino energije, ki je povezana z njegovo frekvenco,[3] da omogoči spremembo energijskega stanja sistema, v primeru atoma je to običajno elektron, ki spreminja orbitale, se foton absorbira. Ko se absorbirana energija zatem spontano odda, bodisi kot foton na isti frekvenci kot prvotni bodisi kot kaskada, v kateri je vsota energij oddanih fotonov enaka energiji absorbiranega fotona, ob predpostavki, da sistem vrne v prvotno stanje.
Spektralne črte so zelo specifične za atome in jih je mogoče uporabiti za identifikacijo kemične sestave katerega koli medija. Več elementov, vključno s helijem, talijem in cezijem, je bilo odkritih ravno s spektroskopijo. Spektralne črte so odvisne tudi od temperature in gostote materiala, zato se pogosto uporabljajo za določanje fizičnih pogojev zvezd in drugih nebesnih teles, ki jih ni mogoče analizirati z drugimi sredstvi.
Spekter elektromagnetnega valovanja ima razpon od žarkov gama s frekvenco 3×1020 Hz in valovno dolžino 10-12 m do radijskih valov s frekvenco 3×105 Hz in valovno dolžino 1 km.
Označevanje uredi
Krepke spektralne črte v vidnem delu elektromagnetnega spektra imajo pogosto edinstveno oznako Fraunhoferjeve črte, kot je na primer K za črto z valovno dolžino 393,366 nm, ki izhaja iz enojno ioniziranega kalcijevega atoma Ca+. Nekatere Fraunhoferjeve črte so mešanice črt več različnih atomov.
V drugih primerih so črte označene glede na stopnjo ionizacije tako, da se oznaki kemičnega elementa doda rimska številka. Nevtralni atomi se označujejo z rimsko številko I, ionizirani atomi pa z II itd.:
- Cu II — bakrov ion z nabojem +1, Cu1+
- Fe III — železov ion z nabojem +2, Fe2+
Podrobnejše oznake običajno vključujejo valovno dolžino črte in lahko vključujejo multipletno število (za atomske črte) ali oznako pasu (za molekularne črte). Številne spektralne črte atomskega vodika imajo tudi oznake znotraj njegovih ustreznih serij, kot sta Lymanova serija ali Balmerjeva serija. Prvotno so bile vse spektralne črte razvrščene v glavno, ostro in difuzno serijo. Te serije obstajajo v atomih vseh elementov. Njihovi vzorci so za vse atome dobro predvideni z Rydberg-Ritzovo formulo. Te serije so kasneje povezali s podorbitalami.
Širjenje in premikanje črt uredi
Oblika spektralne črte je odvisna od več vplivov. Spektralna črta se razteza preko ozkega spektralnega pasu z razponom frekvenc, različnim od nič, in ne ene same frekvence. Njeno središče se lahko premakne z nominalne osrednje valovne dolžine. Razlogov za širjenje in premikanje je več. Razloge je mogoče razdeliti v dve splošni kategoriji – širjenje zaradi lokalnih razmer in širjenje zaradi razširjenih pogojev. Razširitev zaradi lokalnih pogojev je posledica učinkov, ki veljajo v majhnem območju okoli oddajnega elementa, običajno dovolj majhnem, da zagotovi lokalno termodinamično ravnovesje. Razširitev zaradi razširjenih pogojev je lahko posledica vplivov na poti od vira do opazovalca, na primer združevanja sevanj iz več med seboj oddaljenih virov.
Spektralne črte kemičnih elementov uredi
Pasovi uredi
Če besedna zveza "spektralne črte" ni kvalificirana, se običajno nanaša na črte z valovno dolžino v vidnem pasu celotnega elektromagnetnega spektra. Veliko spektralnih črt je na valovnih dolžinah izven tega območja. Črte s krajšimi valovnimi dolžinami, ki ustrezajo višjim energijam, so v ultravijoličnem delu spektra. Mednje spadajo na primer spektralne črte Lymanove serije vodika. Črte s še krajšimi valovnimi dolžinami v pasu rentgenskih žarkov ostanejo za dani kemični element večinoma nespremenjene in so neodvisne od njihovega kemičnega okolja. Daljše valovne dolžine ustrezajo nižjim energijam. Med infrardeče spektralne črte spada na primer Pashenova serija vodika. Pri še daljših valovnih dolžinah vključuje radijski spekter 21-cm črto, ki se uporablja za zaznavanje nevtralnega vodika v celotnem vesolju.
Vidna svetloba uredi
Vsi elementi v naslednji preglednici imajo spektralne črte v vidnem spektru pri valovnih dolžinah okoli 400-700 nm.
| Element | Z | Simbol | Spektralne črte |
|---|---|---|---|
| vodik | 1 | H | |
| helij | 2 | He | |
| litij | 3 | Li | |
| berilij | 4 | Be | |
| bor | 5 | B | |
| ogljik | 6 | C | |
| dušik | 7 | N | |
| kisik | 8 | O | |
| fluor | 9 | F | |
| neon | 10 | Ne | |
| natrij | 11 | Na | |
| magnezij | 12 | Mg | |
| aluminij | 13 | Al | |
| silicij | 14 | Si | |
| fosfor | 15 | P | |
| žveplo | 16 | S | |
| klor | 17 | Cl | |
| argon | 18 | Ar | |
| kalij | 19 | K | |
| kalcij | 20 | Ca | |
| skandij | 21 | Sc | |
| titan | 22 | Ti | |
| vanadij | 23 | V | |
| krom | 24 | Cr | |
| mangan | 25 | Mn | |
| železo | 26 | Fe | |
| kobalt | 27 | Co | |
| nikelj | 28 | Ni | |
| baker | 29 | Cu | |
| cink | 30 | Zn | |
| galij | 31 | Ga | |
| germanij | 32 | Ge | |
| arzen | 33 | As | |
| selen | 34 | Se | |
| brom | 35 | Br | |
| kripton | 36 | Kr | |
| rubidij | 37 | Rb | |
| stroncij | 38 | Sr | |
| itrij | 39 | Y | |
| cirkonij | 40 | Zr | |
| niobij | 41 | Nb | |
| molibden | 42 | Mo | |
| tehnecij | 43 | Tc | |
| rutenij | 44 | Ru | |
| rodij | 45 | Rh | |
| paladij | 46 | Pd | |
| srebro | 47 | Ag | |
| kadmij | 48 | Cd | |
| indij | 49 | In | |
| kositer | 50 | Sn | |
| antimon | 51 | Sb | |
| telur | 52 | Te | |
| jod | 53 | I | |
| ksenon | 54 | Xe | |
| cezij | 55 | Cs | |
| barij | 56 | Ba | |
| lantan | 57 | La | |
| cerij | 58 | Ce | |
| prazeodim | 59 | Pr | |
| neodim | 60 | Nd | |
| prometij | 61 | Pm | |
| samarij | 62 | Sm | |
| evropij | 63 | Eu | |
| gadolinij | 64 | Gd | |
| terbij | 65 | Tb | |
| disprozij | 66 | Dy | |
| holmij | 67 | Ho | |
| erbij | 68 | Er | |
| tulij | 69 | Tm | |
| iterbij | 70 | Yb | |
| lutecij | 71 | Lu | |
| hafnij | 72 | Hf | |
| tantal | 73 | Ta | |
| volfram | 74 | W | |
| renij | 75 | Re | |
| osmij | 76 | Os | |
| iridij | 77 | Ir | |
| platina | 78 | Pt | |
| zlato | 79 | Au | |
| živo srebro | 80 | Hg | |
| talij | 81 | Tl | |
| svinec | 82 | Pb | |
| bizmut | 83 | Bi | |
| polonij | 84 | Po | |
| astat | 85 | At | |
| radon | 86 | Rn | |
| francij | 87 | Fr | |
| radij | 88 | Ra | |
| aktinij | 89 | Ac | |
| torij | 90 | Th | |
| protaktinij | 91 | Pa | |
| uran | 92 | U | |
| neptunij | 93 | Np | |
| plutonij | 94 | Pu | |
| americij | 95 | Am | |
| kirij | 96 | Cm | |
| berkelij | 97 | Bk | |
| kalifornij | 98 | Cf | |
| ajnštajnij | 99 | Es | |
| fermium–oganesson | 101–118 | Fm–Og |
Sklici uredi
- ↑ Kramida, Alexander; Ralchenko, Yuri (1999), NIST Atomic Spectra Database, NIST Standard Reference Database 78, National Institute of Standards and Technology, pridobljeno 27. junija 2021
- ↑ Rothman, L.S.; Gordon, I.E.; Babikov, Y.; Barbe, A.; Chris Benner, D.; Bernath, P.F.; Birk, M.; Bizzocchi, L.; Boudon, V.; Brown, L.R.; Campargue, A.; Chance, K.; Cohen, E.A.; Coudert, L.H.; Devi, V.M.; Drouin, B.J.; Fayt, A.; Flaud, J.-M.; Gamache, R.R.; Harrison, J.J.; Hartmann, J.-M.; Hill, C.; Hodges, J.T.; Jacquemart, D.; Jolly, A.; Lamouroux, J.; Le Roy, R.J.; Li, G.; Long, D.A.; in sod. (2013). »The HITRAN2012 molecular spectroscopic database«. Journal of Quantitative Spectroscopy and Radiative Transfer. 130: 4–50. Bibcode:2013JQSRT.130....4R. doi:10.1016/j.jqsrt.2013.07.002. ISSN 0022-4073.
- ↑ Einstein, Albert (1905). On a Heuristic Viewpoint Concerning the Production and Transformation of Light.