Plumban
Plumban je kovinski hidrid s kemijsko formulo PbH4 in ena od 14 svinčevih spojin z vodikom.[1] Plumban ni niti dobro znan niti dobro opisan. Je termodinamično nestabilen in zlahka odceplja vodik.[2] Derivata plumbana str svinčev tetrafluorid (PbF4) in tetraetilsvinec ((CH3CH2)4Pb).
| |

| |
| Imena | |
|---|---|
| IUPAC ime
Plumban
| |
| Druga imena
plumban, svinčev tetrahidrid, tetrahidrosvinec, svinčev(IV) hidrid
| |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChEBI | |
| ChemSpider | |
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| PbH4 | |
| Molska masa | 211,23 g/mol |
| Vrelišče | −13 °C (9 °F; 260 K) |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Zgodovina
urediDo nedavnega ni bilo zanesljivo znano, ali je bil plumban kdaj dejansko sintetiziran,[3] čeprav prva poročila o sintezi segajo v dvajseta leta 20. stoletja.[4] Leta 1963 sta Saalfeld in Svec poročala, da sta odkrila PbH4 z masno spektrometrijo.[5] Plumban je bil večkrat predmet Dirac-Hartree-Fockove relativistične kalkulacijske študije, ki je raziskovala stabilnosti, geometrije in relativne energije hidridov s formulo MH4 ali MH2.[2][6][7]
Lastnosti
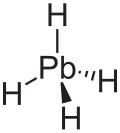
urediPlumban je nestabilen brezbarven plin, najtežji iz skupine IV hidridov.[8] Ima tetraedrično (Td) zgradbo z ravnotežno razdaljo med svincem in vodikom 1,73 Å.[9] Formalni oksidacijski stanji vodika in svinca sta -1 and +4, ker je elektronegativnost vodika višja od elektronegativnosti svinca. Stabilnost kovinskih hidridov s formulo MH4 (M = C do Pb) z naraščakočim vrstnim številom kovine pada.
Priprava
urediZgodnje študije PbH4 so pokazale, da je molekula nestabilna v primerjavi z njenimi lažjimi analogi (silan, german in stanan).[10] Plumban se ne more sintetizirati po postopkih za sintezo germana (GeH4) in stanana (SnH4).
Leta 1999 so plumban sintetizirali iz svinčevega(II) nitrata (Pb(NO3)2) in natrijevega borohidrida NaBH4.[11] Leta 2005 so poročali o nenascentnem mehanizmu za sintezo plumbana.[12]
Leta 2003 sta Wang in Andrews skrbno preučila pripravo PbH4 z lasersko ablacijo in prepoznala njegove infrardeče (IR) pasove.[13]
Sklici
uredi- ↑ Porritt, C.J. (1975). Chem. Ind-London. 9: 398.
- ↑ 2,0 2,1 Hein, Thomas A.; Thiel, Walter; Lee, Timothy J. (1993). "Ab initio study of the stability and vibrational spectra of plumbane, methylplumbane, and homologous compounds". The Journal of Physical Chemistry. 97 (17): 4381–4385. doi: 10.1021/j100119a021. hdl: 11858/00-001M-0000-0028-1862-2.
- ↑ Cotton, F. A.; Wilkinson, G.; Murillo, C. A.; Bochman, M. Advanced Inorganic Chemistry. Wiley: New York, 1999.
- ↑ Paneth, Fritz; Nörring, Otto (1920). "Über Bleiwasserstoff". Berichte der Deutschen Chemischen Gesellschaft (A and B Series). 53 (9): 1693–1710. doi: 10.1002/cber.19200530915.
- ↑ Saalfeld, Fred E.; Svec, Harry J. (1963). "The Mass Spectra of Volatile Hydrides. I. The Monoelemental Hydrides of the Group IVB and VB Elements". Inorganic Chemistry. 2: 46–50. doi: 10.1021/ic50005a014.
- ↑ Desclaux, J.P.; Pyykko, P. (1974). "Relativistic and non-relativistic Hartree-Fock one-centre expansion calculations for the series CH4 to PbH4within the spherical approximation". Chemical Physics Letters. 29 (4): 534–539. Bibcode:1974CPL....29..534D. doi:10.1016/0009-2614(74)85085-2.
- ↑ Pyykkö, P.; Desclaux, J.P. (1977). "Dirac–Fock one-centre calculations show (114)H4 to resemble PbH4". Nature. 266 (5600): 336–337.Bibcode: 1977Natur.266..336P. doi:10.1038/266336a0.
- ↑ CRC Handbook of Chemistry and Physics. Online Edition.
- ↑ Visser, O.; Visscher, L.; Aerts, P. J. C.; Nieuwpoort, W. C. (1992). "Relativistic all-electron molecular Hartree-Fock-Dirac-(Breit) calculations on CH4, SiH4, GeH4, SnH4, PbH4". Theoretica Chimica Acta. 81 (6): 405–416.doi:10.1007/BF01134864.
- ↑ Malli, Gulzari L.; Siegert, Martin; Turner, David P. (2004). "Relativistic and electron correlation effects for molecules of heavy elements: Ab initio fully relativistic coupled-cluster calculations for PbH4". International Journal of Quantum Chemistry. 99 (6): 940–949. doi:10.1002/qua.20142.
- ↑ Krivtsun, V. M.; Kuritsyn, Y. A.; Snegirev, E. P. (1999). "Observation of IR absorption spectra of the unstable PbH4 molecule" (PDF). Opt. Spectrosc. 86 (5): 686–691. Bibcode:1999OptSp..86..686K. Arhivirano iz izvirnika (PDF) 4. marca 2016. Pridobljeno 31. decembra 2012.
- ↑ Zou, Y; Jin, FX; Chen, ZJ; Qiu, DR; Yang, PY (2005). "Non-nascent hydrogen mechanism of plumbane generation". Guang Pu Xue Yu Guang Pu Fen Xi = Guang Pu. 25 (10): 1720–3. PMID 16395924.
- ↑ Wang, Xuefeng; Andrews, Lester (2003). "Infrared Spectra of Group 14 Hydrides in Solid Hydrogen: Experimental Observation of PbH4, Pb2H2, and Pb2H4". Journal of the American Chemical Society. 125 (21): 6581–6587.doi:10.1021/ja029862l. PMID 12785799.