Spinalna mišična atrofija
Spinalna mišična atrofija (SMA) je skupina živčno-mišičnih motenj, ki se kažejo kot napredujoča mišična oslabelost zaradi degeneracije spodnjega motoričnega nevrona hrbtenjače.[1][3] Nekatere oblike spinalne mišične atrofije se pokažejo že takoj po rojstvu ali celo pred njim, medtem ko se druge izrazijo šele v odraslosti.[1] Pri vseh oblikah spinalne mišične atrofije se mišična oslabelost s časom slabša, spremljajo pa jo mišične fascikulacije (omejene, nehotene mišične kontrakcije, vidne skozi kožo).[1][4] Praviloma so najprej prizadete mišice rok in nog ter dihalne mišice.[4][5] Spremljajoči simptomi in znaki so lahko težave s požiranjem, skolioza (ukrivljenost hrbtenice) in sklepne kontrakture.[2][5] Spinalna mišična atrofija je vodilni genetski vzrok smrti pri majhnih otrocih.[6]
| Spinalna mišična atrofija | |
|---|---|
| Sopomenke | atrophia muscularis spinalis, 5q spinalna mišična atrofija |
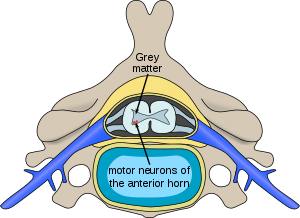 | |
| Lokacija nevronov v hrbtenjači, ki so prizadeti pri spinalni mišični atrofiji | |
| Specialnost | nevrologija |
| Simptomi | napredujoča mišična oslabelost[1] |
| Zapleti | skolioza, sklepne kontrakture, pljučnica[2] |
| Tipi | tipi I do IV[2] |
| Vzroki | mutacija gena SMN1[2] |
| Diagnostični postopki | genetsko testiranje[1] |
| Diferencialne diagnoze | prirojena mišična distrofija, duchennova mišična distrofija, prader-willijev sindrom[2] |
| Zdravljenje | podporno zdravljenje, zdravila[1] |
| Zdravila | nusinersen, onasemnogen abeparvovek |
| Prognoza | odvisno od tipa bolezni[2] |
| Pogostost | 1 na 10.000 prebivalcev[2] |
SMA je posledica mutacije gena SMN1.[1][2] S staršev na otroke se deduje avtosomno recesivno.[1] Gen SMN1 nosi zapis za beljakovino preživetja motoričnega nevrona (SMA, angl. survival of motor neuron), ki je, kot ime pove, nujna za preživetje motoričnih nevronov.[5] Izguba teh nevronov prepreči prenos signalov iz možganov v skeletno mišičje.[5] Sum na diagnozo zdravniki postavijo na osnovi simptomatike, potrdijo pa jo z genetskim testiranjem.[1]
Pri lajšanju simptomov spinalne mišične atrofije se lahko uporabi podporno zdravljenje, kot so fizikalna terapija, dodajanje ustreznih hranil in mehanična ventilacija.[1] Zdravilo nusinersen, ki se injicira intratekalno, upočasni napredovanje bolezni in izboljša mišično funkcijo.[1][4] Leta 2019 je ameriški Urad za prehrano in zdravila odobril zdravilo za gensko zdravljenje onasemnogen abeparvovek za zdravljenje otrok, mlajših od 24 mesecev.[6] Prognoza je odvisna od tipa bolezni, in sicer od nekajmesečnega preživetja do blage mišične oslabelosti ob normalni pričakovani življenjski dobi.[5] Prizadene okoli 1 na 10.000 novorojencev.[2]
Razvrstitev uredi
Spinalna mišična atrofija se kaže z različno hudostjo ter lahko prizadene bodisi majhne otroke ali pa se pokaže šele v odraslosti. Bolezen se razvršča v 3 do 5 tipov, in sicer glede na starost, pri kateri nastopijo simptomi, ali pa glede na doseženo stopnjo motorike.
Najpogostejša je naslednja razvrstitev:
| Tip | Eponim | Povprečna starost nastopa simptomov | Značilnosti | OMIM |
|---|---|---|---|---|
| SMA1 (infantilni tip)[3] |
werdnig–hoffmannova bolezen | 0–6 mesecev | Huda oblika infantilnega tipa SMA se pojavi že v prvem mesecu življenja, pogosto z nenadnim, naglim nastopom (»sindrom ohlapnega otroka«). Hitro odmiranje motoričnih nevronov vodi v neučinkovitost življenjsko pomembnih organov, zlasti dihal. Najpogostejši vzrok bolezni je dihalna odpoved zaradi pljučnice. Če otrok s SMA1 ni mehanično ventiliran, praviloma ne doseže starosti več od dveh let, pri najhujših oblikah bolezni lahko smrt nastopi že v nekaj tednih (tako hudo in hitro obliko SMA včasih razvrščajo v poseben tip, SMA0). Otroci z blažjo obliko SMA1, ki se pojavlja pri okoli 10 % vseh otrok s SMA1, lahko ob ustreznem podpornem zdravljenju doživijo adolescenco ali odraslost. | 253300 |
| SMA2 (kronični infantilni tip)[3] |
dubowitzova bolezen | 6–18 mesecev | Pri kroničnem infantilnem tipu SMA otroci nikoli ne dosežejo samostojnosti pri stoji in hoji, so pa zmožni vsaj v nekem obdobju življenja vztrajati v sedečem položaju. Nastop mišične oslabelosti se praviloma opazi med 6. in 18. mesecem otrokovega življenja. Napredovanje bolezni je zelo različno; nekateri otroci imajo čedalje hujšo mišično oslabelost, pri drugih pa ob ustreznem podpornem zdravljenju do nadaljnjega poslabšanja ne pride. Lahko se pojavi skolioza in pri tem lahko opornica pomaga pri olajšanju dihanja. Telesne mišice so oslabljene in ogrožena so predvsem dihala. Pričakovana življenjska doba bolnikov s SMA2 je krajša, vendar bolniki povečini dosežejo odraslost. | 253550 |
| SMA3 (juvenilni tip)[3] |
bolezen po Kugelbergu in Lisi Welander | > 12 mesecev | Juvenilni tip SMA se običajno izrazi po 12. mesecu starosti. Otrok lahko v določenem obdonju samostojno hodi, čeprav je pri velikem deležu bolnikov hoja kasneje ob napredovanju bolezni onemogočena. Prizadetost dihal je manj izražena, pričakovana življenjska doba pa je nespremenjena ali skoraj nespremenjena. | 253400 |
| SMA4 (adultni tip)[3] |
odraslost | Adultni (odrasli) tip SMA (včasih razvrščen tudi kot SMA3 s poznim nastopom) običajno nastopi po tretjem desetletju življenja in se kaže kot napredujoča mišična oslabelost. Prizadene zlasti proksimalne mišice okončin; bolniki pogosto potrebujejo ob napredovali bolezni invalidski voziček. Drugi zapleti so redki, pričakovana življenjska doba pa ni okrnjena. | 271150 |
Najhujša oblika SMA tipa 1 se včasih razvršča posebej, kot SMA tipa 0 (ali huda infantilna SMA); diagnosticirajo jo pri novorojencih, ki se rodijo tako slabotni, da preživijo le nekaj tednov, četudi so deležni intenzivne respiratorne podpore. SMARD1 je bolezen s podobno simptomatiko, vendar njen potek ni enak in vzrok ni mutacija gena SMA.
Motorični razvoj bolnikov s SMA1 se ponavadi ocenjuje z validiranim ocenjevalnikom CHOP INTEND (angl. The Children's Hospital of Philadelphia Infant Test of Neuromuscular Disorders), pri bolnikih s SMA2 ali SMA3 pa z oceno mere gibalne sposobnosti (MFM, angl. Motor Function Measure) ali eno od različic hammersmithove funkcionalne motorične lestvice.[7][8][9][10]
Eponimsko poimenovanje SMA1, werdnig–hoffmannova bolezen, se nanaša na nevrologa Johanna Hoffmanna in Guida Werdniga,[11] ki sta bolezen prva opisala. Bolezen po Kugelbergu in Lisi Welander kot eponimsko poimenovanje SMA2 se nanaša na Erika Klasa Hendrika Kugelberga (1913–1983) in Liso Welander (1909–2001), ki sta opredelila razliko med SMA in mišično distrofijo.[12] Redko poimenovanje za SMA3, dubowitzova bolezen (ni isto kot dubowitzov sindrom) se nanaša na Victorja Dobowitza, angleškega nevrologa, avtorja več študij o SMA.
Simptomi in znaki uredi
Simptomatika pri SMA je lahko zelo različna in je odvisna od tipa bolezni, stopnje napredovalosti ter tudi dejavnikov pri posamezniku. Naslednji simptomi so najmočneje izraženi pri najhujši obliki SMA1:[13][14][15]
- arefleksija (odsotnost refleksov), zlasti v okončinah
- splošna mišična oslabelost (običajno je simetrična), slab mišični tonus, mišična mlahavost, upadanje mišične sposobnosti
- težave pri doseganju motoričnih mejnikov v razvoju, težave pri sedenju/stoji/hoji
- pri majhnih otrocih sedenje z nogami v »žabjem položaju« (abdukcija kolkov, fleksija kolen)
- oslabelost dihalnih mišic: šibek kašelj, šibek jok pri majhnih otrocih, kopičenje izločkov v dihalih, oteženo dihanje
- zvonasto oblikovan trup pri hujših oblikah SMA (zaradi uporabe le trebušnih mišic pri dihanju)
- fascikulacije (majhne, nehotne mišične kontrakcije) jezika
- težave pri sesanju, požiranju (in posledična slaba prehranjenost)
Vzrok uredi
Spinalna mišična atrofija je posledica mutacije v genu SMN1.[16] Človeški 5. kromosom vsebuje na lokaciji 5q13 dva skorajda enaka gena, telomerno kopijo SMA1 in centromerno kopijo SMA2. Pri zdravih posameznikih gen SMA1 nosi zapis za funkcionalno beljakovino preživetja motoričnega nevrona (SMN, angl. survival of motor neuron), ki je, kot ime pove, nujna za preživetje motoričnih nevronov. Gen SMA2 se razlikuje le v enem nukleotidu (840.C→T), vendar zato podleže alternativnem izrezovanju na stiku med intronom 6 in eksonom 8 in le 10–20 % prepisov (transkriptov) gena SMA2 zapisuje povsem funkcionalno beljakovino SMA, preostalih 80–90 % zapisov pa nosi zapis za skrajšan beljakovinski produkt (SMNΔ7), ki se v celici hitro razgradi.[17]
Pri bolnikih s spinalno mišično atrofijo je gen SMN1 mutiran na način, da ne nosi več pravega zapisa za beljakovino SMN. In sicer je gen mutiran tako, da pride do delecije[18] na eksonu 7[19] ali do točkovne mutacije (ki pogosto vodi do funkcionalne pretvorbe SMN1 v SMN2). Skorajda vsi bolniki imajo vsaj eno funkcionalno kopijo gena SMN2 (pri večini jih je 2–4), ki še vedno nosi zapis za majhno količino beljakovine SMN (10–20 % normalnih ravni) in omogoča, da nekateri motorični nevroni preživijo. Dolgoročno pa znatno zmanjšane količine funkcionalne beljakovine SMN vodijo do postopnega odmiranja motoričnih nevronov v prednjem rogu hrbtenjače in v možganih. Motorični nevroni so eferentni nevroni v osrednjem živčevju, katerih nevriti se končujejo v celicah skeletnih mišic. Mišice, ki so oživčene z odmrlim motoričnim nevronom, tako izgubljajo oživčenost in zmanjšuje se pritok signalov iz osrednjega živčevja. Posledično se slabša kontraktilnost mišic, le-te pa sčasoma atrofirajo (usihajo).
Praviloma so najprej prizadete mišice spodnjih okončin, sledijo mišice zgornjih okončin, hrbtenice in vratu ter pri hujših oblikah bolezni še dihalne mišice in žvečne mišice. Vedno so prej in močneje prizadete proksimalne mišice v primerjavi z distalnimi.[20]
Hudost bolezni je tesno povezana z obsegom, v katerem lahko preostali gen SMN2 nadomešča funkcijo gena SMN1. Deloma je to povezano s številom kopij gena SMN2 na kromosomu. Zdravi posamezniki nosijo na 5. kromosomu dva gena SMN2, pri bolnikih s SMA pa je lahko njihovo število od 1 do 4 (ali celo več); več je kopij gena SMN2, blažji so načeloma simptomi. Večina otrok s SMA1 ima eno ali dve kopiji gena SMN2, bolniki s SMA2 ali SMA3 imajo ponavadi tri kopije in bolniki s SMA4 imajo načeloma vsaj 4 kopije gena SMN2. Vendar pa povezava med hudostjo simptomatike in številom kopij gena SMN2 ni absolutna in najverjetneje obstajajo še drugi dejavniki, ki vplivajo na fenotip bolezni.[21]
Spinalna mišična atrofija se deduje avtosomno recesivno; okvarjen gen se nahaja na avtosomu, nespolnem kromosomu, bolezen se pa izrazi, če posameznik prejme po en okvarjen gen od vsakega od staršev. Starši so lahko prenašalci, ne da bi se pri njih pojavili simptomi. Pri okoli 2 do 4 % primerov se bolezen pojavi de novo, ne pa z dedovanjem okvarjenih genov.
Prizadene posameznike vseh ras, za razliko od nekaterih drugih dednih bolezni, pri katerih je pojavnost bistveno različna med različnimi rasami (na primer cistična foibroza ali srpastocelična anemija). Povprečna razširjenost bolezni, skupno vseh podtipov in pri vseh rasah, je okoli 1 na 10.000 posameznikov. Pogostnost okvarjenega gena je 1:100, kar pomeni, da je približno 1 od 50 posameznikov prenašalec bolezni.[22][23] Prenašalstvo nima nobenih znanih posledic na zdravje posameznika. Oseba lahko spozna svoj status prenašalstva, če je prizadet njegov otrok ali pa če mu napravijo gensko testiranje.
Sorojenci s SMA imajo običajno zelo podobno obliko bolezni, vendar pa obstaja možnost pojava različnih tipov bolezni pri otrocih v isti družini. Slednje je redko in je lahko posledica dodatne de novo delecije gena SMN, neprizadetost gena NAIP ali pa razlike v številu kopij gena SMN2.
Diagnoza uredi
Sum na diagnozo zdravniki postavijo na osnovi simptomatike, potrdijo pa jo z genetskim testiranjem.[1] Ob sumu na SM se najprej opravi molekularnogenetsko testiranje, in sicer test mutacije v genu SMN1.[14] Test ima 95-% občutljivost in skoraj 100-% specifičnost.[15] Homozigotna delecija eksona 7 v genu SMN1 (z delecijo eksona 8 ali brez nje) potrjuje diagnozo SMA. Drugi testi se opravijo le v primeru, če je izvid testa delecije v genu SMN1 negativen.[14]
Zdravljenje uredi
Zdravljenje je bilo do nedavno le podporno, v zadnjih letih pa je prišlo do razvoja specifičnih oblik zdravljenja. Dokončno možnost ozdravitve bolezni bi omogočilo gensko zdravljenje, s popravo okvarjenega gena oz. nadomestitvijo le-tega z neokrnjenim genom SMN1. [24]
Programi celovite obravnave bolnika s hujšo obliko SMA zahtevajo multidisciplinarno timsko obravnavo na terciarni ravni. V timu so potrebni strokovnjaki različnih področij, kot so genetik, pediater, nevrolog, pulmolog, gastroenterolog, kardiolog, ortoped, fizioterapevt, psiholog, dietetik itd.[25]
Dihala uredi
Bolezen pljuč je glavni vzrok obolevnosti in smrtnosti pri SMA tipov 1 in 2 ter deloma tudi pri tipu 3. Brez podpore pljučne funkcije nesedeči umrejo pred 2 letom starosti. Pljučna prizadetost je posledica oslabelosti dihalnih mišic, pri sedečih in hodečih pa je pljučna funkcija dodatno prizadeta zaradi skolioze. Prispevajo tudi motnje hranjenja in gastroezofagealni refluks. Pljučna funkcija slabi zaradi ponavljajočih se okužb pljuč, nočnih desaturacij kisika v krvi, nočne hipoventilacije in dnevne hiperkapnije.[15] Dihalna podpora je nujna, ko se pri obolelemu razvije dnevna hiperkapnija. Ob prisotnosti motenj dihanja med spanjem je smiselna podpora dihanju preko noči. Če bolnik ne more samostojno uspešno izkašljevati, je potrebna podpora izkašljevanju (asistirano izkašljevanje). Ob pojavu bakterijske pljučnice je potrebno ustrezno antibiotično zdravljenje.[14]
Prebavila in prehrana uredi
Zlasti nesedeči in sedeči oboleli imajo pogosto motnje hranjenja in požiranja. Pomembno je preprečevanje aspiracij in izboljšanje hranjenja. Možni ukrepi so, na primer, sprememba konsistence hrane, namestitev bolnika v pravilen položaj med hranjenjem, uporaba ustreznih opornic, nadomeščanje hranil s prehranskimi dopolnili. Če hranjenje skozi usta ni možno ali varno, je lahko potrebno hranjenje po želodčni cevki.[14]
Oboleli s SMA lahko imajo poleg težav s hranjenjem druge težave, povezane s prebavili, kot so gastroezofagealni refluks, zaprtje, zakasnitve v praznjenju želodca in napenjanje, in ki lahko zahtevajo podporno zdravljenje (na primer uporaba antacidov, probiotikov ...).[14]
Specifično zdravljenje z zdravili uredi
Decembra 2016 je ameriški Urad za prehrano in zdravila (FDA) odobril zdravilo nusinersen kot prvo specifično zdravilo za zdravljenje SMA.[26] Evropska agencija za zdravila je zdravilo odobrila maja 2017.[27] Gre za protismiselni nukleotid, ki temelji na spremenjenem prepisovanju gena SMN2, tako da se poveča količina učinkovite beljakovine SMN in se tako doseže izboljšanje stanja.[24]
Maja 2019 je FDA odobril Novartisovo zdravilo za gensko zdravljenje onasemnogen abeparvovek za zdravljenje bolnikov s SMA do starosti 24 mesecev.[28] Gre za zdravilo za napredno zdravljenje, ki v Evropi še nima dovoljenja za promet.[29] Zdravilo temelji na nadomeščanju gena SMN1 v celicah, in sicer preko vnosa transgena SMN1 v celična jedra s pomočjo uporabe virusnega vektorja.[30] S ceno preko dveh milijonov dolarjev gre za najdražji enkratni odmerek zdravila doslej.[31]
Sklici uredi
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 »Spinal muscular atrophy«. Genetic and Rare Diseases Information Center (GARD) – an NCATS Program. Pridobljeno 27. maja 2019.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 »Spinal Muscular Atrophy«. NORD (National Organization for Rare Disorders). Pridobljeno 27. maja 2019.
- ↑ 3,0 3,1 3,2 3,3 3,4 https://www.termania.net/slovarji/slovenski-medicinski-slovar/5507259/atrofija?query=atrofija&SearchIn=All, Slovenski medicinski e-slovar, vpogled: 23. 10. 2019.
- ↑ 4,0 4,1 4,2 »Spinal Muscular Atrophy Fact Sheet | National Institute of Neurological Disorders and Stroke«. NINDS. Pridobljeno 27. maja 2019.
- ↑ 5,0 5,1 5,2 5,3 5,4 »Spinal muscular atrophy«. Genetics Home Reference (v angleščini). Pridobljeno 27. maja 2019.
- ↑ 6,0 6,1 »FDA approves innovative gene therapy to treat pediatric patients with spinal muscular atrophy, a rare disease and leading genetic cause of infant mortality«. FDA (v angleščini). 24. maj 2019. Pridobljeno 27. maja 2019.
- ↑ Main M, Kairon H, Mercuri E, Muntoni F (2003). »The Hammersmith functional motor scale for children with spinal muscular atrophy: a scale to test ability and monitor progress in children with limited ambulation«. European Journal of Paediatric Neurology. 7 (4): 155–159. doi:10.1016/S1090-3798(03)00060-6. PMID 12865054.
- ↑ Krosschell KJ, Maczulski JA, Crawford TO, Scott C, Swoboda KJ (Julij 2006). »A modified Hammersmith functional motor scale for use in multi-center research on spinal muscular atrophy«. Neuromuscular Disorders. 16 (7): 417–426. doi:10.1016/j.nmd.2006.03.015. PMC 3260054. PMID 16750368.
- ↑ O'Hagen JM, Glanzman AM, McDermott MP, Ryan PA, Flickinger J, Quigley J, Riley S, Sanborn E, Irvine C, Martens WB, Annis C, Tawil R, Oskoui M, Darras BT, Finkel RS, De Vivo DC (Oktober 2007). »An expanded version of the Hammersmith Functional Motor Scale for SMA II and III patients«. Neuromuscular Disorders. 17 (9–10): 693–7. doi:10.1016/j.nmd.2007.05.009. PMID 17658255.
- ↑ Glanzman AM, O'Hagen JM, McDermott MP, Martens WB, Flickinger J, Riley S, Quigley J, Montes J, Dunaway S, Deng L, Chung WK, Tawil R, Darras BT, De Vivo DC, Kaufmann P, Finkel RS, in sod. (Pediatric Neuromuscular Clinical Research Network for Spinal Muscular Atrophy (PNCR)) (december 2011). »Validation of the Expanded Hammersmith Functional Motor Scale in spinal muscular atrophy type II and III«. Journal of Child Neurology. 26 (12): 1499–1507. doi:10.1177/0883073811420294. PMID 21940700.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ https://www.termania.net/slovarji/slovenski-medicinski-slovar/5544505/werdnig-guido?query=werdnig&SearchIn=All, Slovenski medicinski e-slovar, vpogled: 24. 10. 2019.
- ↑ Dubowitz V (Januar 2009). »Ramblings in the history of spinal muscular atrophy«. Neuromuscular Disorders. 19 (1): 69–73. doi:10.1016/j.nmd.2008.10.004. PMID 18951794.
- ↑ Oskoui M, Darras BT, DeVivo DC (2017). »Chapter 1«. V Sumner CJ, Paushkin S, Ko CP (ur.). Spinal Muscular Atrophy: Disease Mechanisms. Elsevier. ISBN 978-0-12-803685-3.
- ↑ 14,0 14,1 14,2 14,3 14,4 14,5 https://treat-nmd.org/wp-content/uploads/2016/09/Slovenian-SMA-final-153.pdf Arhivirano 2019-10-24 na Wayback Machine. Standardi za obravnavo spinalne mišične atrofije; Vodnik za družine obolelih s spinalno mišično atrofijo. Ljubljana: Društvo distrofikov Slovenije, 2016.
- ↑ 15,0 15,1 15,2 https://www.kclj.si/dokumenti/Smernice-SMA-UKCL-pednevro.pdf Smernice obravnave otrok s spinalno mišično atrofijo. Klinični oddelek za otroško, mladostniško in razvojno nevrologijo, Pediatrična klinika Ljubljana, 3. februar 2011.
- ↑ Brzustowicz LM, Lehner T, Castilla LH, Penchaszadeh GK, Wilhelmsen KC, Daniels R, Davies KE, Leppert M, Ziter F, Wood D (april 1990). »Genetic mapping of chronic childhood-onset spinal muscular atrophy to chromosome 5q11.2-13.3«. Nature. 344 (6266): 540–541. Bibcode:1990Natur.344..540B. doi:10.1038/344540a0. PMID 2320125.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ »Spinal muscular atrophy«. Genetics Home Reference. Pridobljeno 15. maja 2019.
- ↑ Lefebvre S, Bürglen L, Reboullet S, Clermont O, Burlet P, Viollet L, Benichou B, Cruaud C, Millasseau P, Zeviani M (Januar 1995). »Identification and characterization of a spinal muscular atrophy-determining gene«. Cell. 80 (1): 155–165. doi:10.1016/0092-8674(95)90460-3. PMID 7813012.
- ↑ Passini MA, Bu J, Richards AM, Kinnecom C, Sardi SP, Stanek LM, Hua Y, Rigo F, Matson J, Hung G, Kaye EM, Shihabuddin LS, Krainer AR, Bennett CF, Cheng SH (Marec 2011). »Antisense oligonucleotides delivered to the mouse CNS ameliorate symptoms of severe spinal muscular atrophy«. Science Translational Medicine. 3 (72): 72ra18. doi:10.1126/scitranslmed.3001777. PMC 3140425. PMID 21368223.
- ↑ Wang CH, Finkel RS, Bertini ES, Schroth M, Simonds A, Wong B, Aloysius A, Morrison L, Main M, Crawford TO, Trela A (Avgust 2007). »Consensus statement for standard of care in spinal muscular atrophy«. Journal of Child Neurology. 22 (8): 1027–1049. doi:10.1177/0883073807305788. PMID 17761659.
- ↑ Jedrzejowska M, Milewski M, Zimowski J, Borkowska J, Kostera-Pruszczyk A, Sielska D, Jurek M, Hausmanowa-Petrusewicz I (2009). »Phenotype modifiers of spinal muscular atrophy: the number of SMN2 gene copies, deletion in the NAIP gene and probably gender influence the course of the disease«. Acta Biochimica Polonica. 56 (1): 103–108. doi:10.18388/abp.2009_2521. PMID 19287802.
- ↑ Su YN, Hung CC, Lin SY, Chen FY, Chern JP, Tsai C, Chang TS, Yang CC, Li H, Ho HN, Lee CN (Februar 2011). Schrijver I (ur.). »Carrier screening for spinal muscular atrophy (SMA) in 107,611 pregnant women during the period 2005-2009: a prospective population-based cohort study«. PLOS ONE. 6 (2): e17067. Bibcode:2011PLoSO...617067S. doi:10.1371/journal.pone.0017067. PMC 3045421. PMID 21364876.
- ↑ Sugarman EA, Nagan N, Zhu H, Akmaev VR, Zhou Z, Rohlfs EM, Flynn K, Hendrickson BC, Scholl T, Sirko-Osadsa DA, Allitto BA (Januar 2012). »Pan-ethnic carrier screening and prenatal diagnosis for spinal muscular atrophy: clinical laboratory analysis of >72,400 specimens«. European Journal of Human Genetics. 20 (1): 27–32. doi:10.1038/ejhg.2011.134. PMC 3234503. PMID 21811307.
- ↑ 24,0 24,1 https://www.kclj.si/dokumenti/spm_Na_Pediatricni_kliniki_priceli_z_zdravljenjem_otroka_s_SMA_tip_I_07032017.pdf Sporočilo za medije; Na Pediatrični kliniki pričeli z zdravljenjem otroka s SMA tip I. UKC Ljubljana, Ljubljana, 7. marec 2017, dostop: 24. 10. 2019.
- ↑ Sabadin T., Rogelj M., Pisk A. Pomen vzpostavitve registra za spremljanje otrok z živčno-mišičnimi boleznimi, fizioterapevtska obravnava in prikaz primera. Slov Pediatr 2018; 25: 24-30.
- ↑ https://www.fda.gov/news-events/press-announcements/fda-approves-first-drug-spinal-muscular-atrophy, vpogled: 9. 10. 2019.
- ↑ https://www.ema.europa.eu/en/documents/product-information/spinraza-epar-product-information_sl.pdf Povzetek glavnih značilnosti zdravila Spinraza, vpogled: 9. 10. 2019.
- ↑ https://www.fda.gov/vaccines-blood-biologics/zolgensma, vpogled: 24. 10. 2019.
- ↑ https://www.jazmp.si/fileadmin/datoteke/dokumenti/Razno/Zakonodaja_o_zdravilih_in_dostopnost_zdravil_za_redke_bolezni_-_izjava_za_javnost.pdf Zakonodaja o zdravilih in dostopnost zdravil za redke bolezni – izjava za javnost, Javna agencija Republike Slovenije za zdravila in medicinske pripomočke, 17. 10. 2019, vpogled: 24. 10. 2019.
- ↑ https://www.theguardian.com/science/2019/may/25/21m-novartis-gene-therapy-to-become-worlds-most-expensive-drug, "$2.1m Novartis gene therapy to become world's most expensive drug". The Guardian. Reuters. 25. 5.2019, vpogled: 27. 10. 2019.
- ↑ http://www.drustvo-distrofikov.si/?p=18471, vpogled: 24. 10. 2019.